
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、标况下,4.48L SO2中含O原子数为0.4NA |
| B、常温常压下,8.96LCO2中所含分子数为0.4 NA |
| C、500mL 0.1 mol/L的NaOH溶液中含OH-的数目为0.05NA |
| D、常温常压下,1.6g CH4中含H原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
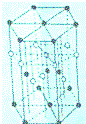 已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:
已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 | 用CCl4提取溴水中的溴 | 除去乙醇中的I2 | 加热分解MgCl2?6H2O 得到纯净的MgCl2 | 配制100mL0.1000mol/L-1K2CR 2O溶 |
| 装置或仪器 | 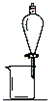 |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
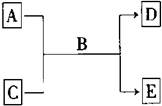 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl(MgCl2)--加过量KOH溶液 |
| B、CO2(SO2)--通过足量NaOH溶液 |
| C、MnO2(KClO3)--加足量的水 |
| D、Na2CO3(Na2SO4)--加足量的BaCl2 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com