
| m |
| n |
| 0.4mol |
| 2 |
| 19g |
| 0.2mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、+33.1kJ?mol-1 |
| B、-81.5 kJ?mol-1 |
| C、+45.2 kJ?mol-1 |
| D、-33.1 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(CN)2可以和H2反应 |
| B、(CN)2不能和碱反应 |
| C、CN-具有还原性 |
| D、(CN)2的性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,7.8gNa2O2与足量CO2完全反应,转移电子数为0.2 NA |
| B、28g 硅单质中所含的Si-Si共价键数目为2NA |
| C、标况下22.4LC2H4和C3H6的混合气体完全燃烧后,生成的CO2分子数目为2.5NA |
| D、pH=13的NaOH溶液中所含的OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-+CO32-+2H+═HCO3-+H2O |
| B、2OH-+CO32-+3H+═HCO3-+2H2O |
| C、2OH-+CO32-+4H+═CO2+3H2O |
| D、OH-+CO32-+3H+═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
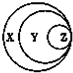 如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )| 选项 | X | Y | Z |
| A | 混合物 | 溶液 | 胶体 |
| B | 酸 | 强酸 | 硫酸 |
| C | 纯净物 | 无机物 | 甲烷 |
| D | 化合物 | 碱性氧化物 | 酸性氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com