
科目:高中化学 来源:2015-2016学年甘肃省高二上期中测试化学试卷(解析版) 题型:选择题
由乙烯推测丙烯的结构或性质正确的是
A.分子中三个碳原子在同一条直线上 B.分子中所有原子都在同一平面上
C.与HCl加成只生成一种产物 D.能发生加聚反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高二上12月月考化学卷(解析版) 题型:选择题
将下列各种液体:①苯;②四氯化碳;③碘化钾溶液;④乙炔;⑤裂化汽油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是
A.②⑤ B.只有②④ C.①②④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上12月月考化学试卷(解析版) 题型:选择题
下面有关Na2CO3与NaHCO3的性质说法错误的是
A.热稳定性:NaHCO3<Na2CO3
B.不可用氢氧化钙鉴别两者
C.两溶液碱性相同时的浓度:Na2CO3>NaHCO3
D.与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
T ℃时在2 L 密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z 的浓度变化如图1 所示;若保持其他条件不变,温度分别为T1 和T2 时,Y 的体积百分含量与时间的关系如图 2 所示。则下列结论不正确的是

A.反应进行的前3 min 内,用X 表示的反应速率υ(X)=0.1 mol·L-1·min-1
B.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K 增大
D.若在相同条件下充入4.0molX,3.2molY,0.8molZ,达到平衡后X 的转化率为30%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl 五种溶液,只用一种试剂把它们区别开,这种试
剂是
A.氨水 B.AgNO3溶液 C.浓NaOH 溶液 D.NaCl 溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省钦南区高一上学期期中质量调研化学试卷(解析版) 题型:选择题
如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是

A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷(解析版) 题型:填空题
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)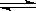 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v= 。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中测试化学试卷(解析版) 题型:实验题
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)
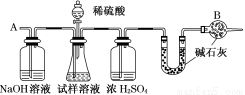
主要实验步骤如下:① 按图组装仪器,并检验装置的气密性
②将10.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到20.0 g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓通入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到22.0 g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2 g
请填空和回答问题:
(1)装置中干燥管B的作用________________________。如果没有连接该干燥管,测试的结果________________________(填偏高、偏低或不变)。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果________(填偏高、偏低或不变)。
(3)步骤⑤的目的是________________________,如果没有进行步骤⑤的操作,测试的结果________________(填偏高、偏低或不变)。
(4)试样中纯碱的质量分数为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com