
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(3)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(4)阳极是活性电极时,阳极本身失电子,生成阳离子;
(5)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)还原1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子6mol,亚铁离子被氧化为+3价,应该得到6mol电子,所以还原1mol Cr2O72-离子,需要6mol的FeSO4•7H2O,故答案为:6;
(3)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(4)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(5)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
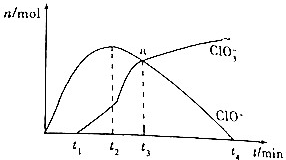 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )| A. | 参加反应所需要NaOH与氯气的物质的量之比一定为2:1 | |
| B. | a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 | |
| C. | t2~t4min,ClO-的物质的量下降的原因可能是3ClO-═2Cl-+ClO${\;}_{3}^{-}$ | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
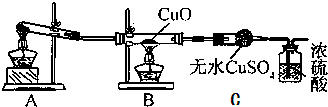
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
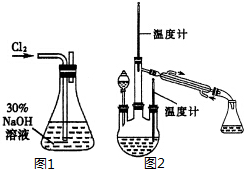 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com