
| A. | 当2a=b时,溶液中生成的沉淀质量最大 | |
| B. | 当a=2b时,发生的离子反应为2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O | |
| C. | 当2b≤3a时,发生的离子反应为3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 当2a<b≤2.5a时,溶液中的n(AlO2-)为0.02(b-2a) mol |
分析 A.沉淀质量最大时,应是硫酸根离子完全反应生成硫酸钡沉淀;
B.当a=2b时,氢氧化钡不足,钡离子与硫酸根离子反应生成硫酸钡沉淀,铝离子先于铵根离子与氢氧根离子反应;
C.当2b≤3a时,氢氧化钡不足,硫酸根离子与钡离子反应生成硫酸钡沉淀,铝离子与氢氧根离子反应生成氢氧化铝沉淀;
D.当2a=b时,发生反应的离子方程式:发生反应的离子方程式:NH4++Al3++2SO42-+Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓,继续加氢氧化钡溶液,氢氧化铝与氢氧根离子反应生成偏铝酸根离子,据此书写离子方程式.
解答 解:A.当2a=b时,硫酸根离子全部转化为硫酸根沉淀,此时沉淀质量最大,故A正确;
B.当a=2b时,发生的离子反应:3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故B错误;
C.当2b≤3a时,氢氧化钡不足,硫酸根离子与钡离子反应生成硫酸钡沉淀,铝离子与氢氧根离子反应生成氢氧化铝沉淀,发生的离子反应为3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故C正确;
D.当2a=b时,发生反应的离子方程式:发生反应的离子方程式:NH4++Al3++2SO42-+Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓,继续加氢氧化钡溶液,氢氧化铝与氢氧根离子反应生成偏铝酸根离子,当b=2.5a时,发生反应的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+H2O,因此:n(AlO2-)为0.02(b-2a) mol,故D正确;
故选:B.
点评 本题考查了离子方程式书写正误判断,侧重考查复分解反应的离子方程式书写,明确离子反应的先后顺序,熟悉反应物用量对反应的影响是解题关键,题目难度较大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和油脂一定条件下都能水解 | |
| B. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 与有机物 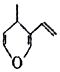 互为同分异构体,且能与NaOH溶液反应的化合物有7种 互为同分异构体,且能与NaOH溶液反应的化合物有7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 将NH4HCO3、AlCl3、FeCl2、KAl(SO4)2的溶液分别加热蒸干、灼烧,均不能得到原物质 | |
| C. | 可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
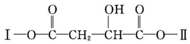 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com