
分析 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目,结合化合价的变化计算.
解答 解:(1)Al元素的化合价升高,失去电子,故答案为:Al;失去;
(2)10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高,被氧化,在反应中失去电子,铝失去电子数为10×3,NaNO3得到电子数为6×5,则用“单线桥法”标明反应中电子转移的方向和数目为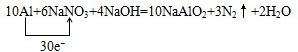 ,
,
故答案为: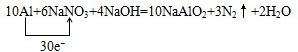 ;
;
(3)产生1mol气体,则转移的电子的物质的量为1mol×2×(5-0)=10mol,则转移1mol电子是生成0.1mol氮气,即2.24L;
故答案为:2.24.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化吸热,故液氨常做制冷剂 | |
| B. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| C. | 浓硝酸和浓硫酸与铜反应都能表现出强氧化性和酸性 | |
| D. | 实验室可用氯化铵固体与氢氧化钠固体共热制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
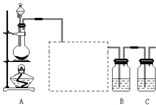 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
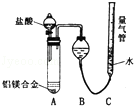 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ②③④ | C. | ②③④⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
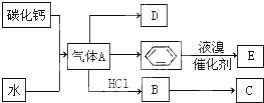
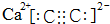 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$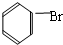 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应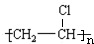 其反应类型为加聚反应
其反应类型为加聚反应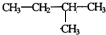 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11 | B. | 15 | C. | 22 | D. | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
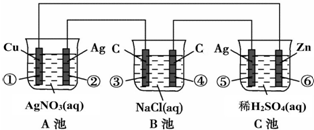
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com