
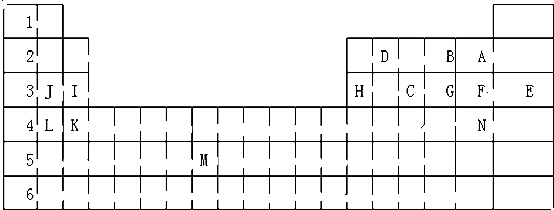


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、等质量的两种盐分别与足量盐酸反应,碳酸钠产生的气体多 |
| B、等质量的两种盐分别与足量盐酸反应,碳酸钠反应更剧烈 |
| C、盐酸滴加到碳酸钠溶液中与碳酸钠溶液滴加到盐酸中,两者的现象相同 |
| D、盐酸滴加到碳酸氢钠溶液中与碳酸氢钠溶液滴加到盐酸中,两者的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人体缺少维生素A易患夜盲症、干眼症 |
| B、玻璃钢广泛用于制造汽车车身、船体和印刷电路板 |
| C、为使火腿肠颜色更鲜红,可多加一些亚硝酸钠 |
| D、碳酸氢钠可作抗酸药,阿司匹林是重要的抗生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置制取并收集氯气,试回答下列问题:
用如图装置制取并收集氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
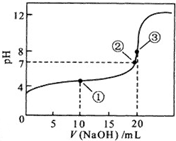 常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.
常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com