
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 |
分析 (1)滴加H2O2能将亚铁离子氧化为三价铁离子便于除去,且不引入杂质,据此书写方程式;
(2)滴加H2O2溶液,稍加热,目的是氧化亚铁离子为三价铁离子便于除去,且不引入杂质,待反应完全后,慢慢加入CuO粉末,搅拌,以控制溶液pH=4,根据题给离子沉淀的PH范围可知,目的是让三价铁离子完全沉淀,铜离子不沉淀;
(3)亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
(4)操作I中用稀硫酸溶解,所以CuO与酸反应,促进三价铁反发生水解反应生成氢氧化铁沉淀;
(5)为了抑制Cu2+在加热过程中水解,Ⅳ中“滤液用稀硫酸酸化;
(6)由硫酸铜溶液获得硫酸铜晶体的方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
解答 解:(1)滴加H2O2能将亚铁离子氧化为三价铁离子便于除去,过氧化氢为氧化剂,二价铁为还原剂,所以反应为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)除去亚铁离子得到纯净的硫酸铜溶液,根据沉淀PH范围可知,应先把亚铁离子转化为三价铁离子,再控制PH,开始沉淀pH2.7,完全沉淀pH3.7,使之完全沉淀,所以滴加H2O2溶液目的是氧化亚铁离子为三价铁离子,再慢慢加入CuO粉末,搅拌,以控制溶液pH=4,目的是在pH=4时铜离子不沉淀,三价铁离子沉淀完全,
故答案为:在调节在pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀;
(3)亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,验证Ⅱ中Fe2+是否转化完全的现象是滴加K3[Fe(CN)6]若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化,
故答案为:若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化;
(4)操作I中加硫酸,向II的溶液中加入CuO粉末至pH为4,CuO和酸反应CuO+2H+=Cu2++H2O,促进三价铁离子水解,所以总反应为2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+,故答案为:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+;
(5)铜离子水解溶液呈酸性,加酸能抑制铜离子水解,所以Ⅳ中“滤液用稀硫酸酸化”目的抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体,
故答案为:用稀硫酸酸化至PH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体;
(6)由硫酸铜溶液获得硫酸铜晶体的方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查了铜的化合物的性质、制备、提纯除杂,利用题给信息,应用难溶物质在不同PH溶液中沉淀的程度不同进行除杂分离的步骤和原理,同时考查了实验基本操作,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁粉作袋装食品的抗氧化剂 | B. | 二氧化硫作纸浆的漂白剂 | ||
| C. | 氢氟酸作普通玻璃的刻蚀剂 | D. | 有机溶剂作食用油的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
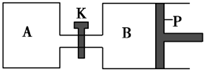 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1.0MPa | 2.0MPa | 3.0MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com