
CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是( )。
A.CH4、NH3、H2O、HF
B.HF、H2O、NH3、CH4
C.H2O、HF、CH4、NH3
D.HF、H2O、CH4、NH3
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:选择题
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )。
A.NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )。
A.Na+(g)+Cl-(g)=NaCl(s) ΔH
B.Na(s)+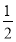 Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1
C.Na(s)=Na(g) ΔH2
D.Na(g)-e-=Na+(g) ΔH3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:填空题
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:选择题
下列各说法中正确的是( )。
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×463 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.1共价键练习卷(解析版) 题型:选择题
下列对共价键的说法中,不正确的是( )。
A.共价键是通过形成共用电子对或原子轨道重叠形成的
B.形成共价键的原子之间电负性相同或相差不大
C.一般情况下一个原子有几个不成对电子就会和几个自旋相反的未成对电子成键
D.共价键是通过共用电子对形成的,不属于电性作用
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:选择题
下列有关电负性的说法中正确的是( )。
A.主族元素的电负性越大,元素原子的第一电离能一定越大
B.在元素周期表中,元素电负性从左到右越来越大
C.金属元素的电负性一定小于非金属元素的电负性
D.在形成化合物时,电负性越小的元素越容易显正价
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:选择题
生产、生活离不开各种化学物质,下列说法不正确的是( )。
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5专题综合检测练习卷(解析版) 题型:选择题
在许多化合物里硫可以取代氧,取代的物质跟原化合物有相似的性质,下列是两种有机磷农药的结构:
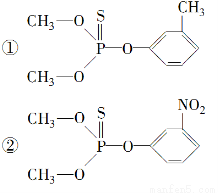
这两种农药在使用过程中不能与下列哪种物质混合使用( )。
A.KCl B.NaOH C.NaNO3 D.Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com