
| A. | 2摩 | B. | 2.5摩 | C. | 1.5摩 | D. | 3摩 |
分析 1mol单质碳在二氧化碳和氧气的混合气体中高温燃烧,可能是和氧气反应生成二氧化碳,也可能是和二氧化碳反应生成CO,据此分类讨论.
解答 解:1mol单质碳在二氧化碳和氧气的混合气体中高温燃烧,可能是和氧气反应生成二氧化碳,也可能是和二氧化碳反应生成CO.
(1)若碳单质和氧气反应,设生成的气体的物质的量为xmol,根据方程式可知:
C+O2 =CO2
1 1
1mol xmol
故有:$\frac{1}{1mol}=\frac{1}{xmol}$
解得x=1mol
(2)若碳和二氧化碳反应生成CO,设生成的CO的物质的量为ymol,则有:
C+CO2 =2CO
1 2
1mol ymol
故有:$\frac{1}{1}=\frac{2}{ymol}$
解得y=2mol
由于是在二氧化碳和氧气的混合物中燃烧,故1mol碳的燃烧产物应介于1mol到2mol之间,故选C.
点评 本题考查了根据反应的实际情况来分类讨论的范围问题,难度不大,应注意是两个极端情况的取舍.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
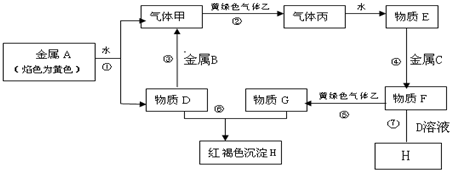
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
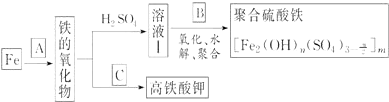
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
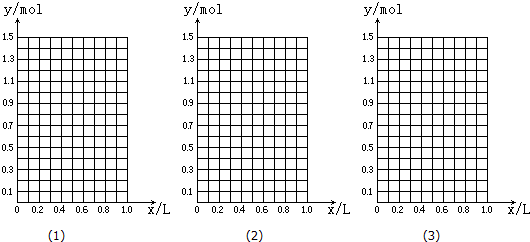
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与常温下氢氧化钠溶液充分反应时转移的电子数为2NA | |
| B. | 1molCu与足量的硫固体反应转移的电子数为NA | |
| C. | 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA | |
| D. | 标准状况下,2.24L三氧化硫所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
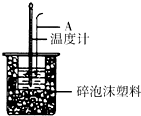 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
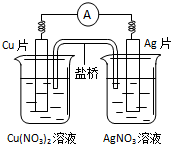
| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com