
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
分析 A.含有弱酸根离子或弱碱阳离子的盐能发生水解;
B.明矾不能杀菌消毒;
C.依据工业制备镁的方法解答;
D.氯化亚铁溶液加热会水解生成氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁.
解答 解:A.含有弱酸根离子或弱碱阳离子的盐能发生水解,醋酸是酸不能发生水解反应,故A错误;
B.明矾溶于水形成的氢氧化铝胶体能吸附不溶性固体杂质小颗粒,形成大颗粒,易于沉降,所以明矾净水,是利用胶体的吸附性,自来水是用强氧化性物质来消毒的,故B错误;
C.氧化镁熔点高,工业上电解熔融的氯化镁来制造金属镁,故C错误;
D.氯化亚铁溶液加热会水解生成氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁,氢氧化铁受热分解生成氧化铁,所以氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁,故D正确;
故选:D.
点评 本题考查物质的性质及应用,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
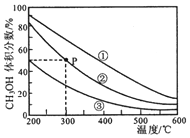
| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com