
·ÖĪö £Ø1£©øł¾ŻÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄŹµŃé²½ÖčŃ”ŌńŗĻŹŹµÄŅĒĘ÷£»
£Ø2£©øł¾ŻČÜŅŗĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±ä¼ĘĖćĖłŠčÅØĮņĖįµÄĢå»ż£¬¾Ż“ĖŃ”ŌńŗĻŹŹµÄĮæĶ²£»
£Ø3£©·ÖĪö²»µ±²Ł×÷¶ŌČÜÖŹµÄĪļÖŹµÄĮæÅضČŗĶČÜŅŗµÄĢå»żµÄÓ°Ļģ£¬ŅĄ¾ŻC=$\frac{n}{V}$½ųŠŠĪó²ī·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©ÓĆÅØČÜŅŗÅäÖĘĻ”ČÜŅŗŅ»°ć²½Öč£ŗĮæČ””¢Ļ”ŹĶ”¢ŅĘŅŗ”¢Ļ“µÓ”¢¶ØČŻ”¢Ņ”ŌČµČ²Ł×÷£¬Ņ»°ćÓĆĮæĶ²ĮæČ”Ņ»¶ØĢå»żµÄÅØČÜŅŗ£¬Č»ŗóŌŚÉÕ±ÖŠĻ”ŹĶ£¬ĄäČ“ŗó×ŖŅʵ½480mLČŻĮæĘæÖŠ£¬²¢ÓĆ²£Į§°ōŅżĮ÷£¬µ±¼ÓĖ®ÖĮŅŗĆę¾ąĄėæĢ¶ČĻß1”«2cmŹ±£¬øÄÓĆ½ŗĶ·µĪ¹ÜµĪ¼Ó£¬
¹Ź“š°øĪŖ£ŗ500mLČŻĮæĘ攢½ŗĶ·µĪ¹Ü”¢ĮæĶ²£»
£Ø2£©ÉčŠčŅŖÅØĮņĖįµÄĢå»żĪŖV£¬øł¾ŻČÜŅŗĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±äµĆ£ŗ0.2mol/L”Į0.5L=18.4mol/L”ĮV£¬V=0.0054L=5.4mL£¬
¹Ź“š°øĪŖ£ŗ5.4£»
£Ø3£©ŅĄ¾ŻC=$\frac{n}{V}$½ųŠŠĪó²ī·ÖĪö£¬
A”¢ÓĆĮæĶ²ĮæČ”ÅØĮņĖįŹ±£¬Ļ“µÓĮæĶ²ŗó½«Ļ“µÓŅŗ×ŖŅʵ½Š”ÉÕ±ÖŠ£¬»įŹ¹ĮņĖįČÜÖŹµÄĪļÖŹµÄĮæĘ«¶ą£¬ÅضČĘ«øߣ»
B”¢¶ØČŻŹ±£¬ŃöŹÓæĢ¶ČĻߣ¬µ¼ÖĀČÜŅŗµÄĢå»żĘ«“ó£¬ČÜŅŗµÄÅضČĘ«µĶ£®
¹Ź“š°øĪŖ£ŗĘ«øߣ»Ę«µĶ£®
µćĘĄ ±¾Ģāæ¼²éĮĖŅ»¶ØĪļÖŹµÄĮæÅضČČÜŅŗµÄÅäÖĘ¼°Īó²ī·ÖĪö£¬ŹģĻ¤ÅäÖĘŌĄķŗĶ¹ż³Ģ¼“æɽā“š£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğÕć½Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
224mLijĘųĢåŌŚ±ź×¼×“æöĻĀµÄÖŹĮæĪŖ0.32g£¬øĆĘųĢåµÄĦ¶ūÖŹĮæĪŖ
A£®32g•mol©1 B£®64 C£®64g•mol©1 D£®64g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
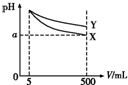 ½«5 mL pH=11µÄX”¢YĮ½ÖÖ¼ī·Ö±šĻ”ŹĶÖĮ500 mL£¬ĘäpHÓėČÜŅŗĢå»ż£ØV£©µÄ¹ŲĻµČēĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
½«5 mL pH=11µÄX”¢YĮ½ÖÖ¼ī·Ö±šĻ”ŹĶÖĮ500 mL£¬ĘäpHÓėČÜŅŗĢå»ż£ØV£©µÄ¹ŲĻµČēĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | ČōX”¢Y¶¼ŹĒČõ¼ī£¬ŌņaµÄÖµŅ»¶Ø“óÓŚ9 | |
| B£® | ĶźČ«ÖŠŗĶX”¢YĮ½ČÜŅŗŹ±£¬ĻūŗÄĶ¬ÅضČĻ”ĮņĖįµÄĢå»żV£ØX£©£¾V£ØY£© | |
| C£® | Ļ”ŹĶŗóXČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č±ČYČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČŠ” | |
| D£® | ČōX”¢YŹĒŅ»ŌŖ¼ī£¬ŌņµČĪļÖŹµÄĮæÅØ¶ČµÄYµÄĻõĖįŃĪČÜŅŗµÄpH±ČXµÄĻõĖįŃĪČÜŅŗ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ŠĀÖĘĀČĖ®æÉŹ¹Ą¶ŅŌŹÆČļŹŌÖ½Ļȱäŗģ£¬ŗóĶŹÉ« | |
| B£® | ŠĀÖĘĀČĖ®ÖŠÖ»ŗ¬ÓŠCl2ŗĶH2O·Ö×Ó | |
| C£® | ĀČĖ®·ÅÖĆŹżĢģŗó£¬ĖįŠŌŌöĒæ | |
| D£® | ¹āÕÕĀČĖ®ÓŠĘųÅŻŅŻ³ö£¬øĆĘųĢåŹĒCl2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ijæĪĶāŠĖȤŠ”×éÓū²ā¶ØijNaOHČÜŅŗµÄÅØ¶Č£¬Ęä²Ł×÷²½ÖčČēĻĀ£ŗ
ijæĪĶāŠĖȤŠ”×éÓū²ā¶ØijNaOHČÜŅŗµÄÅØ¶Č£¬Ęä²Ł×÷²½ÖčČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØH+£©+c£ØNH4+£©=2c£ØOH-£© | |
| B£® | ÓÉH2OµēĄė³öµÄc£ØH+£©=1.0”Į10-12mol•L-1 | |
| C£® | ÓėµČĢå»żµČÅØ¶ČµÄĀČ»Æļ§ČÜŅŗ»ģŗĻc£ØNH4+£©+c£ØNH3•H2O£©=0.02 mol•L-1 | |
| D£® | ÓėµČĢå»żµČÅØ¶ČµÄŃĪĖį»ģŗĻŗóĖłµĆČÜŅŗc£ØOH-£©+c£ØNH3•H2O£©=c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com