
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
分析 (1)从表中数据可知改变的条件是KMnO4浓度,根据褪色时间判断溶液浓度对反应速率的影响反应物浓度增大;
(2)先根据醋酸和高锰酸钾的物质的量判断过量问题,计算高锰酸钾浓度变化量,再根据v=$\frac{△C}{△t}$计算;
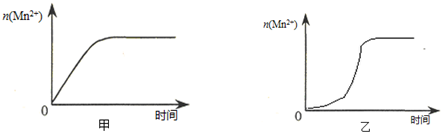
(3)①由图乙可知,反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸锰在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
解答 解:(1)从表中数据,可知改变的条件是KMnO4浓度,其他条件相同时,增大KMnO4浓度,褪色时间变短,则反应速率增大,
故答案为:其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:$\frac{0.2mol•{L}^{-1}×0.003L}{(3+2+3+2)×1{0}^{-3}L}$=0.06mol/L,
这段时间内平均反应速率v(KMnO4)=$\frac{0.06mol•{L}^{-1}}{4min}$=1.5×10-2 mol/(L•min),
故答案为:1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1;
(3)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,
故答案为:实验4与实验1比较,溶液褪色所需时间短或:溶液褪色所用时间(t)小于4min.
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,题目难度不大,注意对比分析图表中的数据找出相同点和不同点,利用控制变量法分析解答,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
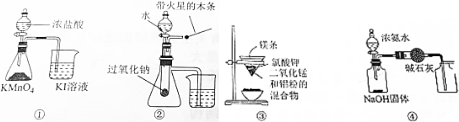
| A. | 用图①装置比较KMnO4、Cl2、I2的氧化性强弱 | |
| B. | 用图②装置验证过氧化钠与水反应既生成氧气又放热 | |
| C. | 用图③装置可制得金属锰 | |
| D. | 用图④装置制取并收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
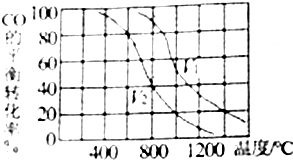
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操作 | 可能出现的现象 | 结论 |
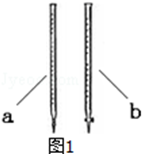
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com