
(9分)下图为周期表中的一部分。已知A、B、C、D均为短周期元素,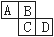
A与D原子序数之和为C原子序数的1.5倍。
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_____ __;A、D两元素的气态氢化物相互反应的生成物的电子式: ,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱: 。
科目:高中化学 来源: 题型:单选题
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是 ( )
| A.X能形成化学式为NaXO3的含氧酸钠盐 |
| B.X元素气态氢化物的水溶液呈酸性 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸。请根据以上信息回答下列问题。
(1)F元素在元素周期表中的位置是______________。
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:______________。
(3)A2C2可以制备C2,该反应的化学方程式是______________。
(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是___________。
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气 的速率变化情况如图所示图中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。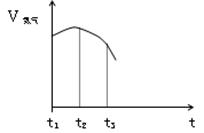
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核 外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为 ;②乙元素在周期表中的位置为 ;③丙元素的最高价氧化物的电子式为 ;④甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B ,C_______,D 。
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程: ;
写出C2B2的电子式 。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。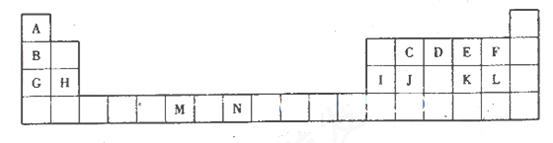
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有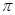 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
(5)D的氢化物的晶体结构如图所示,其化学式是 。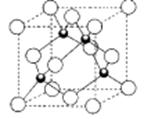
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com