
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是
A. 标准状况下,30.8gCCl4中所含的原子数为NA
B. 100g46%乙醇溶液中含有的H-O键的数目为NA
C. 1molNa2O2与足量的CO2充分反应,转移的电子数为NA
D. n(H2SO3)+n(HSO3-)=1mol的NaHSO3溶液中,含有Na+的数目大于NA
【答案】B
【解析】
A、30.8gCCl4的物质的量为![]() =0.2mol,含有原子1mol,所含的原子数为NA,故A正确;
=0.2mol,含有原子1mol,所含的原子数为NA,故A正确;
B、乙醇溶液中,除了乙醇中含有H-O键外,溶剂水中也含H-O键,而100g46%的乙醇溶液中含乙醇为1mol,故含H-O键数目为NA,含水为54g,物质的量为3mol,故含H-O键数目为6NA,则此溶液中共含7NA个H-O键,故B错误;
C、1mol Na2O2与足量CO2充分反应2Na2O2 +2CO2 = 2Na2CO3 + O2,只有过氧化钠中的O的化合价发生变化,转移的电子数为NA,故C正确;
D、HSO3-在溶液中既能部分水解为H2SO3又能部分电离为SO32-,故当n(H2SO3)+n(HSO3-)=1mol时,NaHSO3的物质的量大于1mol,则钠离子的个数多于NA个,故D正确;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
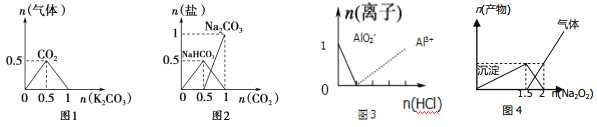
A.图1:n(HCl)=l mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(NaAlO2)=1 mol,HCl加入到NaAlO2溶液中离子的存在情况
D.图4:n(AlCl3)=1 mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为2.25mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
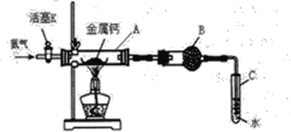
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是
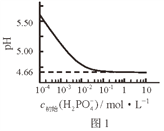
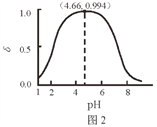
A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷可通过下列反应生成:
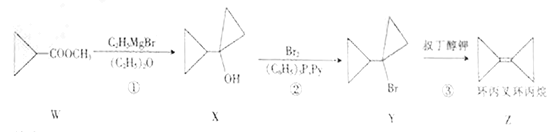
下列说法不正确的是
A. 反应②属于取代反应
B. Z与苯互为同分异构体
C. Z分子中所有碳原子处于同一平面
D. 与W互为同分异构体的链状羧酸类化合物有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有十种物质:①氨水 ②稀硫酸 ③氯化氢 ④NaHSO4 ⑤蔗糖 ⑥二氧化碳 ⑦石墨 ⑧熔融氯化钠 ⑨氢氧化钠 ⑩碳酸钙,请回答下列问题:
(1)属于混合物的是___;属于电解质,但熔融状态下不导电的是___;属于电解质,且难溶于水的是___;属于化合物,但不是电解质的是___;不是电解质,但可以导电的是___;
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___、_____、___;
(3)⑦和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
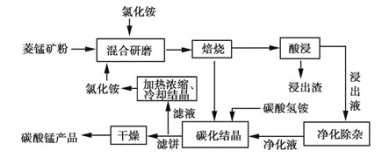
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
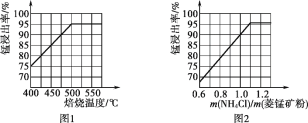
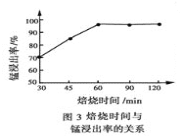
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、![]() 、焙烧时间依次分别为_____、_____、_____。
、焙烧时间依次分别为_____、_____、_____。
(2)浸出液“净化除杂”过程如图:
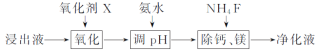
①已知几种氧化剂氧化能力的强弱顺序为:H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择__(填字母)。
A.H2O2 B.Cl2 C.MnO2
②调节pH时,pH可取的范围为______。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com