
 [化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.| 1 |
| 8 |
| 1 |
| 2 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:阅读理解
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
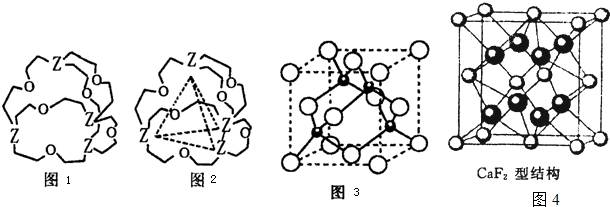
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为 。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三4月双周练习化学试卷(解析版) 题型:填空题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为 。
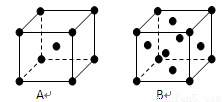
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期开学质量检测化学试卷 题型:填空题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为 。

(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com