
分析 (I)先计算出11g丙烷的物质的量,然后根据燃烧热的定义计算出1mol丙烷燃烧放出的热量,据此写出丙烷燃烧的热化学方程式;
(II)(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)依据盖斯定律计算得到;
(3)结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
解答 解:(I)11g丙烷的物质的量为$\frac{11g}{44g/mol}$=0.25mol,则1mol丙烷完全燃烧放出的热量为:555kJ×$\frac{1mol}{0.25mol}$=2220kJ,则丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1;
(II)(1)C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,依据燃烧热概念可知碳的燃烧热为393.5kJ•mol-1,故答案为:393.5kJ•mol-1;
(2)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律①-②得到H2O(l)=H2O(g)△H=+44KJ/mol,当18gH2O液态水变成气态水时吸热44KJ,
故答案为:+44KJ/mol;
(3)已知:③2C(s)+O2(g)=2CO(g)△H=-110.5kJ•mol-1;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
依据盖斯定律④×2-③得到2CO(g)+O2(g)=2CO2(g)△=-676.5KJ/mol;
CO燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-338.25KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-338.25KJ/mol.
点评 本题考查了热化学方程式的书写方法,盖斯定律计算应用,燃烧热概念分析判断,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
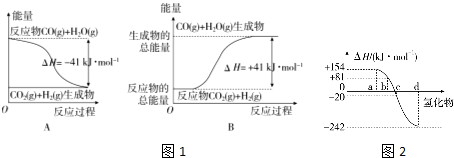
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
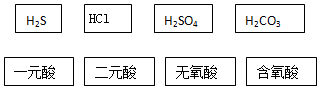
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com