
某小组同学欲制备SO2并探究其性质:
(一)实验室中需要SO2气体22.4 L(标准状况)。依据化学方程式Zn + 2 H2SO4(浓)![]() ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
(1)所制得的气体中混有的杂质气体可能是 (填分子式)。产生这种杂质的主要原因是 (用化学方程式表达)。
(2)为证实相关分析,组装了如下装置,对所制取的气体进行探究。
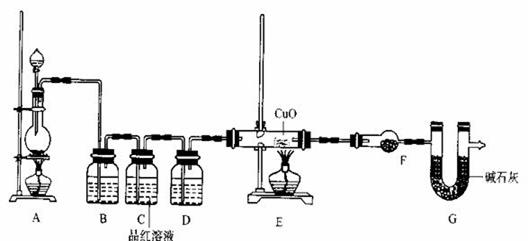
①装置B中加入的试剂是 ,作用是 。
②装置D中加入的试剂是 ,装置F中加入的试剂 是 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有该杂质气体的实验现象是 。
(二)利用下图所示的装置探究S![]() O2的性质:
O2的性质:
已知:熔点![]() :SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
:SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
| |
|
|
(1)装置I模拟工业生产SO3的反应,其化学方程式是 。
(2)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
;装置III中溶液![]() 逐渐褪色,有Mn2+生成,同时溶液酸性
逐渐褪色,有Mn2+生成,同时溶液酸性![]() 增强,则该反应的离子方程式是 。
增强,则该反应的离子方程式是 。
(3)乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol??L-1 NaOH溶液,反应后溶液增重 4.8 g,则反应后溶液中含有的溶质有
(填化学式),对应溶质物质的量之比为 。
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第三次月考化学试卷(解析版) 题型:填空题
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
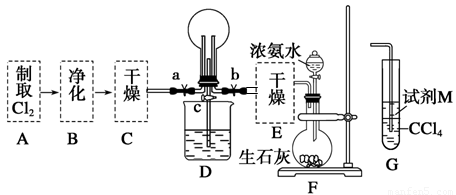
请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式: ,请写出试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是 。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO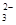 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:

①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO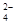 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO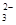 的实验方案为
。
的实验方案为
。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第三次月考化学试卷(解析版) 题型:填空题
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
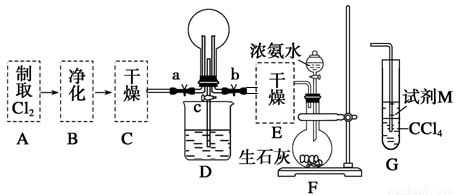
请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式: ,请写出试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是 。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO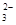 ,可能含有CO
,可能含有CO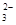 ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO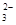 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:

①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO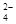 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO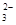 的实验方案为
。
的实验方案为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com