
【题目】已知25℃时Agl饱和溶液中c(Ag+)为1.22×10﹣6mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣6mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO![]() )>c(Cl﹣)>c(Ag+)>c(I﹣)
)>c(Cl﹣)>c(Ag+)>c(I﹣)
B.c(K+)>c(NO![]() )>c(Ag+)>c(Cl﹣)>c(I﹣)
)>c(Ag+)>c(Cl﹣)>c(I﹣)
C.c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
D.c(K+)>c(NO ![]() )>c(Ag+)=(Cl﹣)+c(I﹣)
)>c(Ag+)=(Cl﹣)+c(I﹣)
【答案】A
【解析】解:二者混合时,根据溶度积常数知,先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3 , n(KI)=0.01molL﹣1×5 mL=5.0×10﹣5 mol,消耗n(AgNO3)=5.0×10﹣5mol,
然后发生反应AgNO3+KCl═AgCl↓+KNO3 , 过量的AgNO3为0.01molL﹣1×0.008L﹣5.0×10﹣5 mol=3.0×10﹣5mol,而KCl为n(KCl)=0.01molL﹣1×5 mL=5.0×10﹣5 mol,则KCl过量,生成AgCl为3.0×10﹣5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,
溶液中钾离子、硝酸根离子不参加反应,根据物料守恒得c(K+)>c(NO ![]() ),氯离子有剩余,所以其次是氯离子浓度较大,氯离子抑制碘化银溶解,所以碘离子浓度最小,
),氯离子有剩余,所以其次是氯离子浓度较大,氯离子抑制碘化银溶解,所以碘离子浓度最小,
所以离子浓度大小顺序为:c(K+)>c(NO ![]() )>c(Cl﹣)>c(Ag+)>c(I﹣),
)>c(Cl﹣)>c(Ag+)>c(I﹣),
故选A.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】有aXn-、bYm+两种离子,其电子层结构相同。下列关系或化学式正确的是( )
A.a-n=b+mB.a+m=b+nC.氧化物YOmD.X的氢化物为HnX或XHn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图1给出的装置图回答下列问题: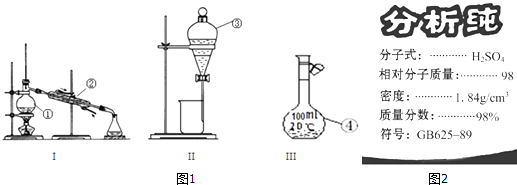
(1)写出下列玻璃仪器的名称:①;② .
(2)①~④中,使用前必须检查是否漏水的是(填仪器序号).分离溴水中的溴应先选择装置(填Ⅰ、Ⅱ或Ⅲ序号)
(3)图2为学校实验室买回的硫酸试剂瓶标签上的部分内容,现欲用此硫酸准确配制浓度为0.18molL﹣1的稀硫酸210mL.
①除量筒、烧杯、玻璃棒、胶头滴管等外,此实验还需要的主要仪器上图有无提供?(填“有”或“无”),如有,在下面横线上填写仪器序号(填①、②、③或④序号),如无,则填写需要怎样的主要仪器: .
②所量取的浓硫酸体积为mL.
③下列操作引起所配溶液浓度偏高的是 .
A.用相同装置配制过0.10mol/L的硫酸溶液后,未清洗即进行此实验的配制
B.移液时未对烧杯和玻璃棒进行洗涤
C.定容时仰视刻度线
D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( ) 
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核外第N层最多可容纳________个电子,当N层为最外层时最多可容纳________个电子,当N层为次外层时最多可容纳_________个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A.3Br2+6KOH=5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C.2KNO3 ![]() 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3 ![]() N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4 , 请按要求填空:
(1)所需浓H2SO4的体积为
(2)如果实验室有10mL、20mL、50mL量筒,应选用mL量筒,实验中用到的仪器除了烧杯、玻璃棒之外,还需要的仪器有:
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即转移到容量瓶
②定容时俯视刻度线
③所用过的烧杯、玻璃棒未洗涤 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com