
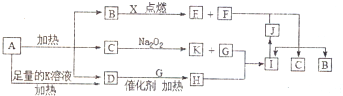
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.分析 短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍,应为Mg元素,A受热分解得到等物质的量的B、C、D三种气态物质,应为NH4HCO3,分解可生成NH3、CO2和H2O,D气体能使湿润的红色石蕊试纸变蓝色,应为NH3,能在B中燃烧的应为CO2和Mg的反应,则C为H2O,B为CO2,K为NaOH,G为O2,H为NO,I为NO2,F为单质应为C,则E为MgO,J为HNO3,结合物质的性质和题目要求可解答该题,
(1)B为CO2,碳原子和每个氧原子形成两个共价键,据此书写电子式,同素异形体是同种元素组成的不同单质,D分子为氨气是三角锥形;
(2)CO2和Mg反应生成MgO和C;
(3)NH4HCO3与足量KOH溶液加热时反应氨气、碳酸钾和水;
(4)2L的NO气体与0.5L的O2气体相混合,若该混合气体被NaOH溶液恰好完全吸收,反应的方程式为4NO+O2+4NaOH=4NaNO2+2H2O;
(5)C和HNO3反应被氧化为CO2,同时硝酸被还原为NO2,C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,N元素化合价降低1价,电子转移总数为4生成NO2物质的量为4mol;
解答 解:短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍,应为Mg元素,A受热分解得到等物质的量的B、C、D三种气态物质,应为NH4HCO3,分解可生成NH3、CO2和H2O,D气体能使湿润的红色石蕊试纸变蓝色,应为NH3,能在B中燃烧的应为CO2和Mg的反应,则C为H2O,B为CO2,K为NaOH,G为O2,H为NO,I为NO2,F为单质,应为C,则E为MgO,J为HNO3,
(1)由以上分析可知B为CO2,电子式为 ,F为C,对应的同素异形体有金刚石、C60、石墨等,D为NH3,为三角锥形结构,
,F为C,对应的同素异形体有金刚石、C60、石墨等,D为NH3,为三角锥形结构,
故答案为: ;金刚石(C60、石墨等);三角锥形;
;金刚石(C60、石墨等);三角锥形;
(2)CO2和Mg反应生成MgO和C,反应的方程式为2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)NH4HCO3与足量KOH溶液加热时反应的离子方程式为NH4++HCO3-+2OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,
故答案为:NH4++HCO3-+2OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O;
(4)2L的NO气体与0.5L的O2气体相混合,若该混合气体被NaOH溶液恰好完全吸收,反应的方程式为4NO+O2+4NaOH=4NaNO2+2H2O,
故答案为:4NO+O2+4NaOH=4NaNO2+2H2O;
(5)C和HNO3反应被氧化为CO2,同时硝酸被还原为NO2,C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,N元素化合价降低1价,电子转移总数为4生成NO2物质的量为4mol,则反应中当转移了4.5mol电子时,生成4.5molNO2,体积=4.5mol×22.4L/mol=100.8L,
故答案为:100.8.
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的性质可反应的特殊性判断物质的种类,学习中注意积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
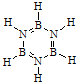 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:| 化学键 | B-H | B-O | B-B |
| 键能(KJ•mol-1) | 389 | 561 | 293 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤③④⑥ | C. | ⑤②③⑧ | D. | ②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 将0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | 将0.1mol•L-1NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 将0.1mol•L-1Na2C2O4溶液与0.1mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y>Z>X | |
| B. | 阴离子的还原性:W>Z | |
| C. | W和其他3种元素均能形成共价化合物 | |
| D. | X、Y、Z三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲酸溶液中水的离子积Kw比乙酸强 | |
| B. | c(酸)相同时,甲酸的导电性比乙酸强 | |
| C. | c(H+)相同时,乙酸的物质的量浓度比甲酸大 | |
| D. | c(酸)相同时,甲酸溶液的pH比乙酸大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
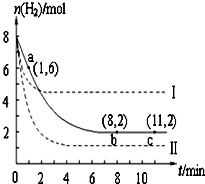 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com