
| A. | 氕和氘 | B. | CH3CH3和CH3CH2CH3 | ||
| C. | 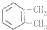 和 和 | D. | O2和O3 |
科目:高中化学 来源: 题型:解答题
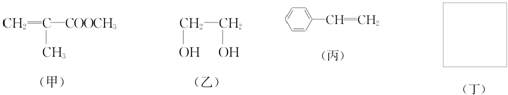
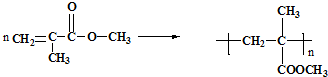
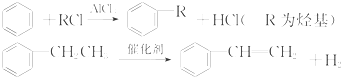 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是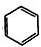 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$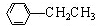 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 遇FeCl3溶液呈紫色,且该物质与苯酚属于同系物 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2的物质的量分别为6mol和7mol | |
| D. | 该分子中的所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子核外电子层排布呈周期性变化 | |
| B. | 元素相对原子质量依次递增 | |
| C. | 元素原子半径大小呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. |  和 和 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com