
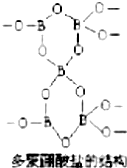
 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
科目:高中化学 来源: 题型:多选题
| A. | 元素的非金属性次序为c>b>a | |
| B. | a和其他3种元素均能形成共价化合物 | |
| C. | 元素b、c的气态氢化物的稳定性:b<c | |
| D. | 元素b、c的最高价氧化物对应的水化物的酸性:b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2) | ||
| C. | 苯、乙醇、四氯化碳(溴水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
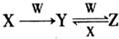 已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.
已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.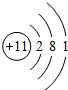 ,用电子式写出C和E形成化合物的过程
,用电子式写出C和E形成化合物的过程 ,用电子式写出A和B形成化合物的过程
,用电子式写出A和B形成化合物的过程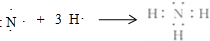 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molNa2CO3的溶液中CO32-的微粒数目 | |
| B. | 常温常压下,22.4 L N2的原子数目 | |
| C. | 46gNO2和N2O4的混合气体中的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| n(A)/mol | 0.40 | - | 0.20 | - | - | 0.10 |
| n(B)/mol | 0.00 | 0.24 | - | 0.52 | 0.60 | 0.60 |
| A. | 0~40 s的平均反应速率v(B)=0.01 mol•L-1•s-1 | |
| B. | 80 s时容器中混合气体的密度小于40 s时混合气体的密度 | |
| C. | 其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol•L-1•s-1 | |
| D. | 反应达到最大限度后,增加A的浓度,B的生成速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
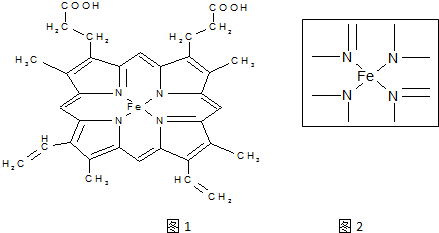
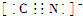 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com