
 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.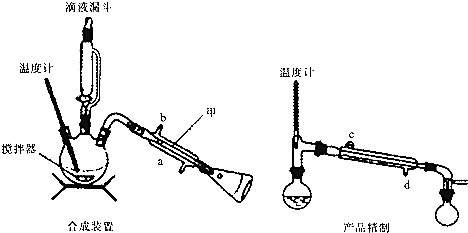
分析 (1)由装置图可知甲仪器的名称;三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸,将40mL次氯酸钠溶液逐渐加入到反应瓶,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,可知溶液的总体积大于100mL;滴液漏斗可以平衡漏斗和三颈烧瓶中的压强,便于液体流下;
(2)用碘化钾淀粉试纸检验反应液,试纸呈蓝色,说明有碘单质生成,根据电子得失守恒和元素守恒书写离子方程式;若检验反应液时,试纸无明显现象,则应继续加入次氯酸钠,直至反应液使碘化钾淀粉试练变蓝,保证环已醇完全被氧化;
(3)加入沸石可以防止瀑沸;
(4)加入无水碳酸钠至反应液呈中性,除去乙酸;
(5)环己酮的沸点为155.6℃;根据题中反应原理可知,5.2mL(5g,0.05mol)环己醇理论上可生成环己酮的质量为0.05mol×98g/mol=4.9g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)检验环己酮是否纯净,即检验没有环己醇即可.
解答 解:(1)由图及常见仪器可知,甲仪器的名称是冷凝管,三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸,将40mL次氯酸钠溶液逐渐加入到反应瓶,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,可知溶液的总体积大于100mL,则三颈烧瓶的容量为250mL,滴液漏斗右边的玻璃导管可将下方的压强转移到上方,则其作用为使所加液体能顺利滴入三颈瓶中,
故答案为:冷凝管;250mL;使所加液体顺利滴入三颈烧瓶中;
(2)用碘化钾淀粉试纸检验反应液,试纸呈蓝色,说明有碘单质生成,反应的离子方程式为ClO-+2CH3COOH+2I-═Cl-+H2O+I2+2CH3COO-,若检验反应液时,试纸无明显现象,则应继续加入次氯酸钠,直至反应液使碘化钾淀粉试练变蓝,保证环已醇完全被氧化,
故答案为:ClO-+2CH3COOH+2I-═Cl-+H2O+I2+2CH3COO-;继续加入次氯酸钠,直至反应液使碘化钾淀粉试练变蓝,保证环已醇完全被氧化;
(3)加入沸石可以防止液体在加热时瀑沸,
故答案为:防止瀑沸;
(4)加入无水碳酸钠至反应液呈中性,目的是将馏出液中的醋酸变成醋酸钠,提高沸点,有利分离子,
故答案为:将馏出液中的醋酸变成醋酸钠,提高沸点,有利分离子;
(5)环己酮的沸点为155.6℃,则对粗产品进行精制,蒸馏收集155.6℃的馏分,根据题中反应原理可知,5.2mL(5g,0.05mol)环己醇理论上可生成环己酮的质量为0.05mol×98g/mol=4.9g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{3.9g}{4.9g}$×100%=79.6%,
故答案为:155.6;79.6%;
(6)检验环己酮是否纯净,则检验没有环己醇即可,醇能与高锰酸钾、Na反应,而酮不能,
故答案为:AB.
点评 本题考查环己酮的制备实验,把握有机物的性质、制备实验中仪器的作用、混合物分离提纯等为解答的关键,侧重分析、实验能力的综合考查,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
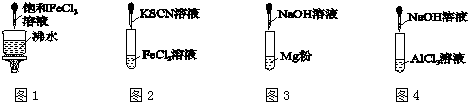
| A. | 图1产生红褐色沉淀 | |
| B. | 图2溶液颜色变红 | |
| C. | 图3放出大量气体 | |
| D. | 图4先出现白色胶状沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨分子的电子式: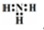 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: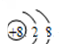 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com