
分析 3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
解答 解:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑中,Cu元素的化合价升高,则Cu为还原剂,N元素的化合价降低,被还原,则NO为还原产物;有11.2L(标准状况)NO气体生成,转移电子为$\frac{11.2L}{22.4L/mol}$×(5-3)×NA=1.5NA,该反应的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,
故答案为:Cu;NO;1.5NA;3Cu+8H++2NO3-=3Cu2++2NO↑+H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将饱和FeCl3溶液逐滴加入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | Al(OH)3胶体能使水中的悬浮颗粒沉降,达到净水的目的 | |
| D. | 豆浆、蔗糖溶液均属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
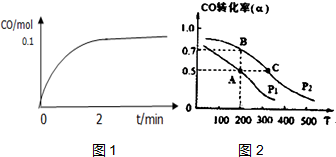 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适,是一类治疗胃痛的药 | |
| B. | 碳酸钙、氢氧化铝都能制成抗酸药 | |
| C. | 青霉素有阻止多种细菌生长的优异功能,虽经1×107 倍稀释,仍有疗效 | |
| D. | 中草药麻黄碱可用于治疗失眠、多梦等症状 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜和盐酸、氢氧化钡和盐酸 | |
| B. | 氯化钡和硫酸钾、氢氧化钡和硫酸 | |
| C. | 澄清石灰水和碳酸钠、氯化钙和碳酸钾 | |
| D. | 碳酸氢钠和硫酸、碳酸钠和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量镁粉的Fe2(SO)3溶液 | |
| B. | FeCl2溶液与稀硝酸混合后的溶液 | |
| C. | 铁丝在足量的氯气中燃烧后所得产物的溶液 | |
| D. | 长期暴露在空气中的绿矾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| B. | Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg | |
| C. | 光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com