
已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是______________________________
________________________________________________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是__________________________________
________________________________________________________________________。
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
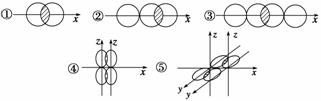
| ① | ② | ③ | ④ | ⑤ | |
| 化学键类型 | |||||
| 举例 |
(2)某有机物的结构式如下:

则分子中有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铝单质的叙述中正确的是( )
A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长
B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属
C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层
D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
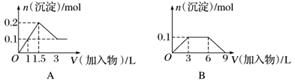
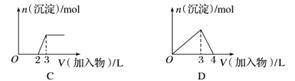
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
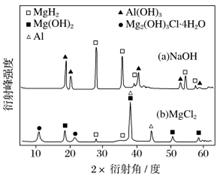
查看答案和解析>>
科目:高中化学 来源: 题型:
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
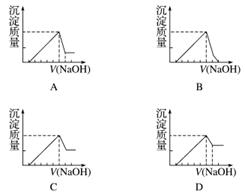
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
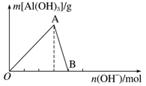
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是___________________。
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
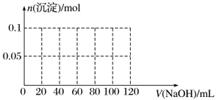
查看答案和解析>>
科目:高中化学 来源: 题型:
气态氯化铝分子以双聚形式存在,其结构式如图所示:
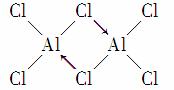
其中Cl→Al表示氯原子提供了一对电子与铝原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个化学方程式右端的两种离子的表达式:
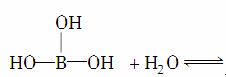 ____________________+________。
____________________+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,水存在H2O??H++OH- ΔH>0的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw不变
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com