
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
【答案】B
【解析】
利用反应CO(g) + H2O(g)![]() CO2(g) + H2(g),采用一边倒的方法将生成物全部转化为反应物,各反应物的浓度分别相等(都为0.01mol/L),则表明相同温度下、三个相同的恒容密闭容器中的平衡为等效平衡,达到平衡时各组分的浓度分别对应相等;容器Ⅰ中,可利用已知数据,并假设CO的浓度变化量为x,建立以下三段式:
CO2(g) + H2(g),采用一边倒的方法将生成物全部转化为反应物,各反应物的浓度分别相等(都为0.01mol/L),则表明相同温度下、三个相同的恒容密闭容器中的平衡为等效平衡,达到平衡时各组分的浓度分别对应相等;容器Ⅰ中,可利用已知数据,并假设CO的浓度变化量为x,建立以下三段式:
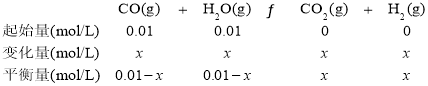
K=![]() =1,解得x=0.005mol/L。
=1,解得x=0.005mol/L。
A.Ⅱ与Ⅰ为恒温恒容下的等效平衡,所以达平衡时,c(H2)=x=0.005 mol·L1,A 正确;
B.III中达平衡时,CO物质的量浓度为0.005mol/L,CO的体积分数为![]() =25%,B不正确;
=25%,B不正确;
C.III可以看成是 Ⅰ 中反应进行的某个阶段,所以达到平衡状态所需的时间比 Ⅰ 中的短,C正确;
D.若III中起始浓度均增加一倍,即相当于加压(气体体积变为原来的一半),由于反应前后气体分子数相等,所以平衡不移动,平衡时c(H2)亦增加一倍,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
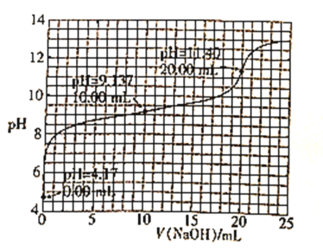
下列说法正确的是( )
A.可用酚酞作滴定指示剂
B.起始时H3BO3的浓度为0.8mol·L-1
C.H3BO3的电离常数数量级为10-5
D.滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,用以下气体做喷泉实验,请根据情况,填写烧瓶中溶液的物质的量浓度(假设烧瓶中溶质不能扩散出来)。
(1)用HCl气体做喷泉实验,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为_______;
(2)用NH3做喷泉实验时,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为____________;
(3)用NO2做喷泉实验时,喷泉结束后,水充至烧瓶的![]() 处,则溶液的物质的量浓度为____________;
处,则溶液的物质的量浓度为____________;
(4)用NO2和O2按4∶1体积比混合,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极)微观示意图。
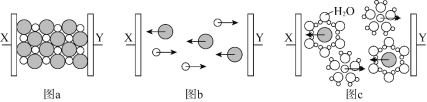
下列说法不正确的是
A.图示中的![]() 代表的离子的电子式为
代表的离子的电子式为![]()
B.图a中放入的是氯化钠固体,该条件下不导电
C.能导电的装置中,X上均有气体产生
D.能导电的装置中,Y的电极产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作____。
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。


(3)能说明SO2具有氧化性的实验现象为_________________。
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值。下列说法正确的是
A.1mol氨基含有的电子数为10 NA
B.标准状况下,22.4 L O2完全转化为Na2O2时转移的电子数为4 NA
C.56 g C3H6和C4H8的混合气体中含有的氢原子数为8 NA
D.0.1 mol·L-1CH3COONa溶液中CH3COO-、CH3COOH数目之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com