
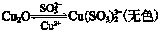
| 操作 | 现象 |
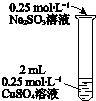 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10mL时,沉淀完全溶解,得无色溶液. |
分析 (1)铜离子水解显酸性;
(2)化合价升高和降低的总数相等;
(3)Cu2O+H2SO4=CuSO4+Cu+H2O;
(4)Cu2SO3易分解生成氧化亚铜;
(5)Cu2O能与Na2SO3反应生成Cu(SO3)23-;
(6)CuSO4溶液和Na2SO3溶液反应生成Cu2O;
(7)CuSO4溶液和Na2SO3溶液反应得到Cu2O,Cu2O和亚硫酸铜反应生成无色Cu(SO3)23-.
解答 解:(1)铜离子水解显酸性,离子方程式Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(2)CuSO4溶液和Na2SO3溶液反应生成氧化亚铜和硫酸根一个铜离子降低1价,一个亚硫酸根升高2价,离子方程式:2Cu2++5SO32-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$1Cu2O+1SO42-+4HSO3-,故答案为:2,5,2H2O,1,1SO42-,4;
(3)Cu2O+H2SO4=CuSO4+Cu+H2O,取少量砖红色沉淀于试管中,加入稀硫酸,溶液变为蓝色,说明砖红色沉淀是Cu2O,故答案为:取少量砖红色沉淀于试管中,加入稀硫酸,溶液变为蓝色,说明砖红色沉淀是Cu2O;
(4)Cu2SO3易分解生成氧化亚铜,化学方程式Cu2SO3═Cu2O+SO2↑,故答案为:Cu2SO3═Cu2O+SO2↑;
(5)Cu2O能与Na2SO3反应生成无色Cu(SO3)23-,故答案为:Cu2O转化得无色Cu(SO3)23-;
(6)CuSO4溶液和Na2SO3溶液反应生成Cu2O砖红色沉淀,故答案为:产生砖红色沉淀,且沉淀不消失;
(7)CuSO4溶液和Na2SO3溶液反应得到Cu2O,Cu2O和亚硫酸铜反应生成无色Cu(SO3)23-,应控制较高的反应温度;CuSO4和Na2SO3的物质的量之比约为1:1,故答案为:反应温度;CuSO4和Na2SO3的物质的量之比.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度不大.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | ⅢA | ⅣA | VA | VIA | VIIA | 0 |
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
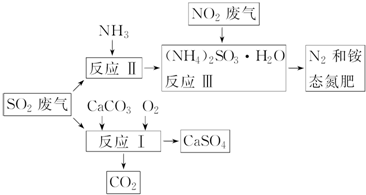
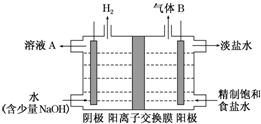
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
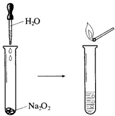 Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.
Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min时,v(C)=$\frac{x}{5}$Vmol•L-1•s-1 | |
| B. | 缩小容器体积平衡一定发生移动 | |
| C. | 0-5min内,v(A):v(C)=a:c | |
| D. | 0-5min内,用A表示的反应速率为$\frac{xc}{300aV}$mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com