
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
分析 (1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(2)同一温度下,容器中气体压强与总的物质的量成正比,根据压强计算平衡时混合气体的物质的量,再根据v=$\frac{△c}{△t}$计算氮气的平均反应速率;根据平衡时各物质的浓度计算其平衡常数.
解答 解:(1)A.2v(H2)正=3v(NH3)逆时,该反应达到平衡状态,所以3v(H2)正=2v(NH3)逆时该反应没有达到平衡状态,故错误;
B.单位时间生成m mol N2的同时消耗3m mol H2,正逆反应速率相等,所以该反应达到平衡状态,故正确;
C.对反应前后气体体积不相等反应,容器内的总压强不再随时间而变化,反应体系中各物质的浓度不变,所以达到平衡状态,故正确;
D.无论该反应是否达到平衡状态,混合气体的密度不随时间变化,所以密度不能作为判断依据,故错误;
E.a molN≡N键断裂的同时,有6amolN-H键断裂,正逆反应速率相等,所以该反应达到平衡状态,故正确;
F.N2、H2、NH3的分子数之比为1:3:2时该反应不一定达到平衡状态,与反应物的初始浓度及转化率有关,故错误;
故选:BCE;
(2)同一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=$\frac{4mol×12.60}{16.80}$=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)?2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=$\frac{1mol×(4-3)mol}{2mol}$=0.5mol,
则从反应开始到25min时,以N2表示的平均反应速率=$\frac{\frac{0.5mol}{2L}}{25min}$=0.01mol/(L•min),
平衡时,c(N2)=$\frac{0.5mol}{2L}$=0.25mol/L、c(H2)=$\frac{3mol-3×0.5mol}{2L}$=0.75mol/L、c(NH3)=$\frac{0.5mol×2}{2L}$=0.5mol/L,化学平衡常数K=$\frac{0.5×0.5}{0.25×(0.75){{\;}^{3}}^{\;}}$=2.37,
故答案为:0.01 mol/(L•min);2.37.
点评 本题考查较综合,涉及化学平衡计算、平衡判断,侧重考查知识运用能力,注意掌握化学平衡状态的判断方法.


科目:高中化学 来源: 题型:实验题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: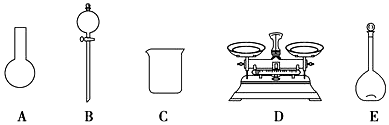
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

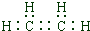 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
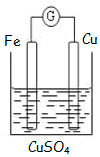 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 |  |  |  |  |
| 实验目的 | 比较非金属性:N>C>Si | 制备并收集乙酸乙酯 | 除去Ca(OH)2中的NH4Cl | 验证HCl的溶解性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com