
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
分析 同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y,
A、电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大;
B、若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能;
C、非金属性越强,最高价含氧酸的酸性越强;
D、电负性X>Y,故原子序数X>Y.
解答 解:同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y,
A、电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大,电负性X>Y,键合电子偏向X原子,偏离Y原子,故X与Y形成化合物中,X显负价,Y显正价,故A错误;
B、若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能,如第一电离能P>S,故B正确;
C、非金属性越强,最高价含氧酸的酸性越强,同周期自左而右元素的非金属性增强,故非金属性X>Y,所以最高价含氧酸的酸性:X强于Y,故C正确;
D、同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y,故D正确;
故选A.
点评 本题考查同种元素性质递变规律、电离能、电负性等,难度不大,注意B中第一电离能的特殊性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
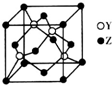 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
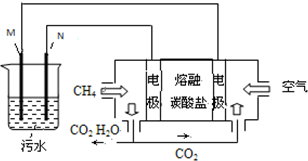 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: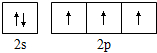 | ||
| C. | CO2的比例模型: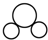 | D. | Cl-的结构示意图: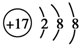 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BCl3、CS2、SO3 | B. | CH4、CH2Cl2、BeCl2 | ||
| C. | P4、SiO2、CO2 | D. | NF3、CCl4、苯(C6H6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
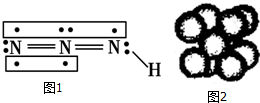 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.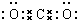 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,均与H2O反应,均属于碱性氧化物 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈无色 | |
| C. | NO、SO2、NO2都是大气污染气体,在空气中都不能稳定存在 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com