
分析 (1)①能和碱反应生成盐和水的氧化物是酸性氧化物,能和酸反应生成盐和水的氧化物是碱性氧化物;
②Ⅰ.二氧化硅和盐酸不反应;
II.镁离子和铁离子都与氢氧根离子反应生成氢氧化物沉淀;
(2)①最高价元素只有氧化性,最低价元素只有还原性,中间价态的元素既有氧化性又有还原性;
②在氧化还原反应中,还原剂失电子化合价升高;
(3)①二氧化硫通入碳酸钠溶液中生成二氧化碳、亚硫酸钠和水;
②二氧化硫通入亚硫酸钠溶液中生成亚硫酸氢钠;
解答 解:(1)①二氧化硅和氢氧化钠溶液反应生成盐和水,所以属于酸性氧化物,氧化镁和氧化铁与盐酸反应生成盐和水,所以属于碱性氧化物,
故答案为:酸性;碱性;
②Ⅰ.氧化镁、氧化铝、氧化铁都和盐酸反应生成盐和水,二氧化硅和盐酸不反应,所以滤渣的主要成分是SiO2,
故答案为:SiO2;
II.镁离子、铁离子和铝离子都能与氢氧根离子反应生成沉淀,但氢氧化铝能和过量的氢氧化钠反应生成可溶性的偏铝酸盐,氢氧化镁和氢氧化铁不与氢氧化钠反应,向滤液中加入NaOH溶液至沉淀的量最大,所以滤渣中的主要成分是Fe(OH)3、Mg(OH)2和Al(OH)3,
故答案为:Fe(OH)3、Mg(OH)2和Al(OH)3;
(2)①最高价元素只有氧化性,最低价元素只有还原性,中间价态的元素既有氧化性又有还原性,二氧化硫中硫元素是中间价态,所以既有氧化性又有还原性,故选C,
故答案为:C;
②在该反应中二氧化硫失电子作还原剂,硫元素化合价升高,故选D,故答案为:D;
(3)亚硫酸(H2SO3)具有中等强度酸性,二氧化碳的水溶液酸性较弱,二氧化硫形成的亚硫酸和碳酸盐反应生成二氧化碳气体,正盐可以转化为酸式盐,
①二氧化硫通入碳酸钠溶液中生成二氧化碳、亚硫酸钠和水,反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2或H2SO3+Na2CO3=Na2SO3+CO2↑+H2O,
故答案为:Na2CO3+SO2=Na2SO3+CO2或H2SO3+Na2CO3=Na2SO3+CO2↑+H2O;
②二氧化硫通入亚硫酸钠溶液中生成亚硫酸氢钠,反应的化学方程式为:Na2SO3+H2O+SO2=2NaHSO3或Na2SO3+H2SO3=2NaHSO3,
故答案为:Na2SO3+H2O+SO2=2NaHSO3或Na2SO3+H2SO3=2NaHSO3;
点评 本题考查酸性氧化物和碱性氧化物概念、氧化还原反应、氢氧化铝两性、二氧化硫性质等知识点,明确元素的化合价与元素性质之间的关系是解本题关键,作为基础是解题关键,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
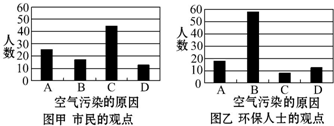
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
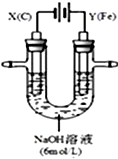 某课外小组分别用如图所示装置对电解原理进行实验探究.
某课外小组分别用如图所示装置对电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、HCO3-、[Al(OH)4]- | ||
| C. | NO3-、Ca2+、K+、Fe2+ | D. | NO3-、K+、[Al(OH)4]-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与硫酸氢钠反应 | B. | 碳酸钾溶液与稀盐酸反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该铜铂电池属于二次电池 | |
| B. | 电子移动方向与纳米发动机移动方向相同 | |
| C. | 铜为铜柏电池的正极 | |
| D. | 铂极发生的电极反应为HBrO+H++2e-=Br-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | |
| D. | 油酸和水,甲苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
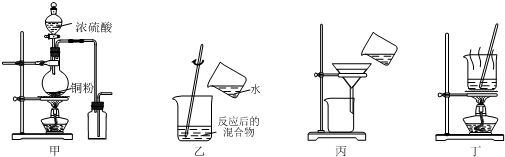
| A. | 用图甲装置制取并收集二氧化硫 | |
| B. | 用图乙装置向反应后的混合物中加水稀释 | |
| C. | 用图丙装置过滤出稀释后混合物中的不溶物 | |
| D. | 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com