
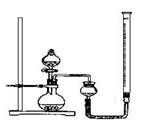
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 | |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
 假设三: ;
假设三: ;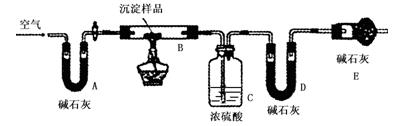
| | B装置的质量(g) | C装置的质量(g) | D装置的质量(g) |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
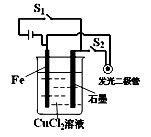
| A.断开开关S1,按下开关S2,化学能转化为电能,电能转化为光能等 |
| B.断开开关S1,按下开关S2,此时构成的装置属于电解池 |
| C.断开开关S2,按下开关S1,此时构成的装置属于原电池 |
| D.断开开关S2,按下开关S1,化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
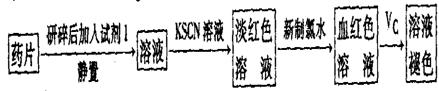
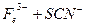
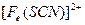 。
。 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。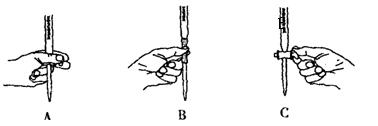
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
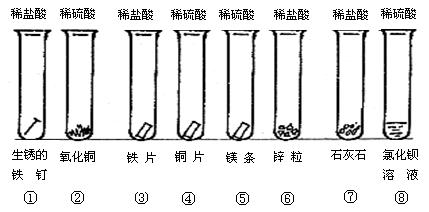
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
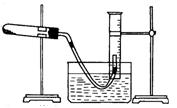
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
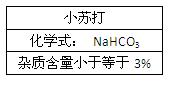
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若_________,则猜想一不成立。 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙 醚,充分振荡、静置分层 | 若乙醚层呈血红色,则___________。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验和观察 | B.预测物质的性质 |
| C.解释及结论 | D.观察物质的外观性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com