
| 选项 | ① | ② | ③ | 实验结论 | 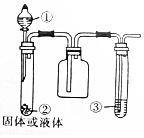 |
| A | 浓氨水 | 生石灰 | 石蕊试液 | 氨气是碱性气体 | |
| B | 浓硝酸 | 铜片 | 淀粉-KI溶液 | NO2水溶液具有氧化性 | |
| C | 浓硫酸 | 亚硫酸钠 | 酸性高锰酸钾溶液 | SO2具有漂白性 | |
| D | 浓盐酸 | 二氧化锰 | 紫色石蕊试液 | 氯气具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生石灰和水反应生成氢氧化钙且放出大量的热,放出的热量导致一水合氨分解生成氨气,氨气溶于水生成的一水合氨电离出大量氢氧根离子而导致氨水呈碱性;
B.浓硝酸和Cu反应生成二氧化氮,二氧化氮能氧化碘离子生成碘;
C.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸;
D.浓盐酸和二氧化锰在加热条件下反应生成氯气,氯气和水反应生成HCl、HClO,酸电离导致溶液呈酸性,HClO具有漂白性.
解答 解:A.生石灰和水反应生成氢氧化钙且放出大量的热,放出的热量导致一水合氨分解生成氨气,氨气溶于水生成的一水合氨电离出大量氢氧根离子而导致氨水呈碱性,氨水能使紫色石蕊试液变红色,由此该实验证明氨气是碱性气体,故A正确;
B.浓硝酸和Cu反应生成二氧化氮,二氧化氮能氧化碘离子生成碘,该实验中二氧化氮和水反应生成的硝酸也能氧化碘离子生成碘,导致淀粉碘化钾溶液变蓝色,因为二氧化氮也具有氧化性,所以该实验不能证明二氧化氮溶液具有氧化性,故B错误;
C.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸,该实验证明二氧化硫具有还原性而不是漂白性,要验证其漂白性应该用品红溶液,故C错误;
D.浓盐酸和二氧化锰在加热条件下反应生成氯气,氯气和水反应生成HCl、HClO,酸电离导致溶液呈酸性,HClO具有漂白性,所以该实验证明氯气水溶液具有酸性和漂白性,而不是氯气具有酸性和漂白性,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析、判断及实验能力,明确元素化合物性质、化学反应原理及物质之间的转化是解本题关键,注意物质检验性质检验时要排除其它因素的干扰,易错选项是D.


科目:高中化学 来源: 题型:选择题
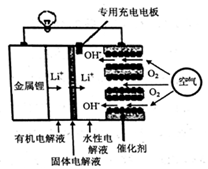
| A. | 正极区产生的LiOH可回收利用 | |
| B. | 电池中的有机电解液可以用稀盐酸代替 | |
| C. | 该电池放电时,正极的反应式为O2+4e-+4H+=2H2O | |
| D. | 该电池充电时,阴极发生了氧化反应:Li++e-=Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
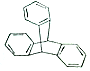 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cu2+、NO3-、S2- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Fe3+、K+、Cl-、I- | D. | Fe2+、Fe3+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com