
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方程式____________________________.
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO)=______mol/L.
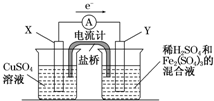
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.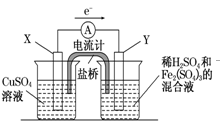
| | 正、负极判断 | 电极材料 | 电极反应式 |
| X极 | | | |
| Y极 | | | |
(1)Cu+2Fe3+===Cu2++2Fe2+
(2)0.64 0.5
(3) 正、负极判断 电极材料 电极反应式 X极 负极 铜 Cu-2e-===Cu2+ Y极 正极 碳 2Fe3++2e-===2Fe2+
解析考查知识点:离子反应;电化学基础;
解答过程:(1)混合液中存在H2SO4和Fe2(SO4)3,铜为不活泼金属,不与H2SO4反应;但Fe3+具有氧化性,可将铜单质氧化为铜离子:Cu+2Fe3+===Cu2++2Fe2+ 。
(2)pH=1,则c(H+)=0.1mol/L;则c(Cu2+)=c(H+)=0.1mol/L;则反应生成的铜离子的物质的量为n(Cu2+)=0.1mol/L×100×10—3L="0.01mol" 。
设反应消耗的铜、Fe3+的物质的量为a、b
Cu+2Fe3+===Cu2++2Fe2+
1 2 1
a b 0.01mol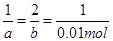 a=0.01mol; b=0.02mol
a=0.01mol; b=0.02mol
则溶解铜的质量m=n·M=0.01mol×64g/mol="0.064g" ;原溶液中Fe3+的浓度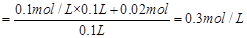 ,根据溶液中正负电荷守恒,可得
,根据溶液中正负电荷守恒,可得
c(H+)+3c(Fe3+)=2c(SO),则SO的浓度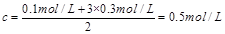
(3)此题主要考查电化学基础,对于电极材料的选择,必须能够导电。由图中电子的移动方向X流向Y,而负极失去电子,故X为负极,发生氧化反应,故其电极材料为铜棒,发生的反应为Cu-2e-===Cu2+;其正极材料为碳棒或石墨,发生反应为:2Fe3++2e-===2Fe2+。
试题点评:本题结合离子反应综合考查了电化学基础以及离子浓度的相关计算,属于中等难度的题目。解题的关键在于熟练的掌握基本的知识点,如“溶液中正负电荷总数相等”、“原电池中,负极失去电子,发生氧化反应;正极得到电子,发生还原反应”、“原电池中电子由负极经导线流向正极”。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)2- 4 |
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
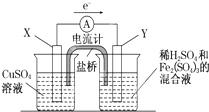 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式______。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO42-)=______mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则X极是 (正、负极),电极反应式 。Y极的材料名称是 ,电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:填空题
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com