
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
分析 (1)碱性溶液应装在碱式滴定管,酸性、氧化性溶液装在酸性滴定管;盐酸中滴入甲基橙显红色,滴入碳酸钠达到终点时溶液变为橙色;
(2)为减小误差,应尽量用浓度小的溶液;
(3)先判断数据的合理性,求出消耗标准碳酸钠溶液体积,依据Na2CO3-2HCl计算盐酸的物质的量浓度.
解答 解:(1)碳酸钠为强碱弱酸盐,水解显碱性,所以应装在碱式滴定管中;盐酸中滴入甲基橙显红色,滴入碳酸钠达到终点时溶液变为橙色;
故答案为:碱,红,橙;
(2)实验时,为减小实验误差,则所用碳酸钠溶液体积不能过小,否则误差较大,应用浓度最小的,
故答案为:③;
(3)依据表中数据可知第1组数据误差较大,舍弃,则消耗标准液碳酸钠的体积为:$\frac{16.95+17.05}{2}$=17.00mL;
则:Na2CO3 -2HCl
1 2
17.00mL×0.025mol/L C(HCl)×20.00mL
解得:C(HCl)=$\frac{17.00mL×0.025mol/L×2}{20.00mL}$;
故答案为:17.00; $\frac{17.00mL×0.025mol/L×2}{20.00mL}$.
点评 本题考查中和滴定操作、计算,为高频考点,侧重于学生的分析、计算和实验能力的考查,注意把握中和滴定的操作原理和实验方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
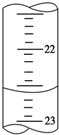 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
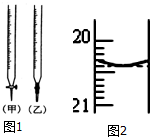 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
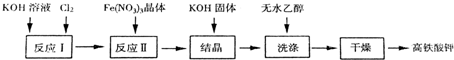
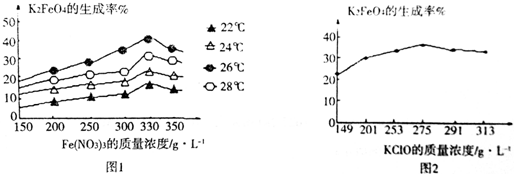
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com