
| A.用四氯化碳萃取溴水中的溴时,将溴的四氣化碳溶液从分液漏斗下口放出 |
| B.用氢氧化钠溶液滴定盐酸的实验中,可通过旋转玻璃活塞调节滴定速率 |
| C.在配制一定物质的量浓度溶液的实验中,若定容时加水超过刻度线应立即用滴管吸出少量水 |
| D.用玻璃棒蘸取溶液滴到放在洁净表面皿上用蒸锻水润湿的pH试纸上,测溶液的pH |
科目:高中化学 来源:不详 题型:单选题
| A.纸层析法进行Cu2+和Fe3+混合液分离时,Fe3+在固定相中分配比例较低 |
| B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C.在铝与过量3mol·L-1硫酸溶液反应的试管中加入少量NaCl固体,反应速率会加快 |
| D.吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
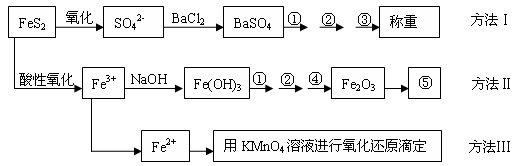
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.过滤操作中,玻璃棒与三层滤纸相互接触 |
| B.过滤操作中,漏斗颈与烧杯内壁相互接触 |
| C.过滤操作中,玻璃棒与烧杯口相互接触 |
| D.为加快过滤,使用玻璃棒搅动漏斗里的液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
| C.称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnCl2溶液 |
| D.用氢氧化铜粉末检测尿糖 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑧⑨ | B.③⑥⑧⑨ | C.⑤⑥⑦⑨ | D.③④⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com