
| A.氨气 | B.乙烯 | C.二氧化碳 | D.二氧化氮 |
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:实验题

| A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
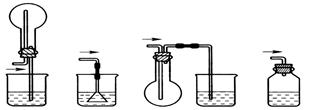
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
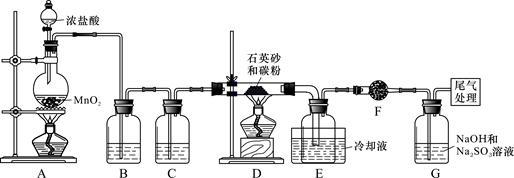
 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
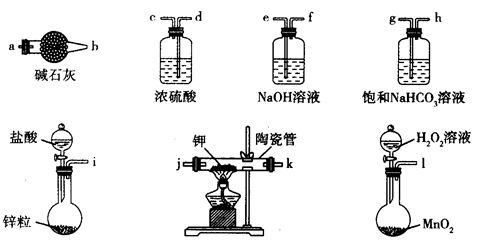
 (2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。
(2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。| 序号 | 操 作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向c试管中滴加几滴 溶液 | | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
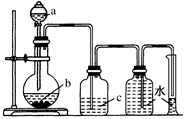
| 选项 | a中的液体 | b中的固体 | c中液体 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 |
| B | 浓氨水 | 生石灰 | 浓H2SO4 |
| C | 浓硫酸 | Cu片 | NaOH溶液 |
| D | 稀HNO3 | Cu片 | H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
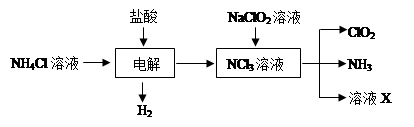
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
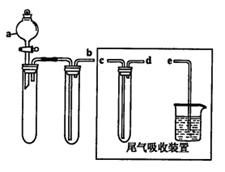
| A.Na2SO3溶液与稀硝酸 |
| B.Na2SO3固体与浓硫酸 |
| C.固体硫和氧气 |
| D.铜与浓硫酸 |
 生产流程,其流程示意图如下:
生产流程,其流程示意图如下: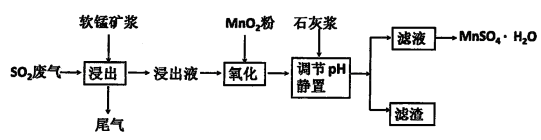
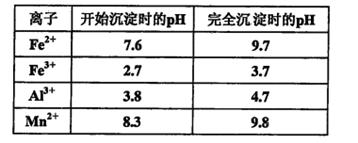
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
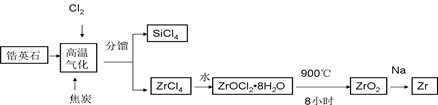
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com