
分析 (1)根据开窗通风可降低室内甲醛的含量分析解答;
(2)为防止温室效应增强,应减少二氧化碳的排放,可从化石燃料、新能源等角度考虑;
(3)钠为活泼金属,容易与水分反应生成具有腐蚀性的氢氧化钠;
(4)氯气能溶于水,也能与烧碱溶液反应.
解答 解:(1)开窗通风可降低室内甲醛的含量,故答案:多开窗通风;
(2)为防止温室效应增强,应减少二氧化碳的排放,少用化石燃料;限制CO2的排放;开发新能源;保护地球上的森林资源;增加城市的绿地面积等等;故答案为:开发新能源;
(3)金属钠性质非常活泼,能够与手上的水分反应生成氢氧化钠,腐蚀皮肤,所以不能用手直接拿取金属钠,
故答案为:金属钠会和手上的水分反应生成氢氧化钠,腐蚀皮肤;
(4)因为氯气能溶于水,也能与烧碱溶液反应,所以消防人员用6个高压水枪同时喷水和稀的烧碱溶液吸收泄漏的氯气,
故答案为:氯气能溶于水,也能与烧碱溶液反应,减少有毒气体氯气的扩散.
点评 本题考查常见生活环境的污染及治理,为高考常见题型和高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学生的学习的积极性,注意基础知识的积累.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是氧化剂 | B. | NH3是氧化剂 | C. | O2被还原 | D. | NH3发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
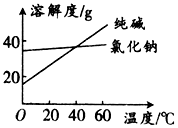 阅读分析下列材料:
阅读分析下列材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是IIIA族元素 | |
| C. | 若元素Y处于第3周期,它的单质可与冷水剧烈反应 | |
| D. | 元素X与氯元素形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
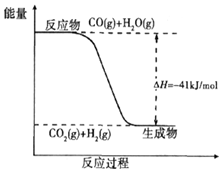 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
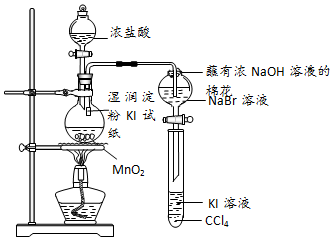
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com