
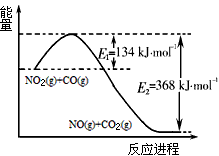
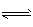 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K= _____________
②试判断K1 __________K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是___________ (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
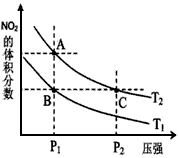
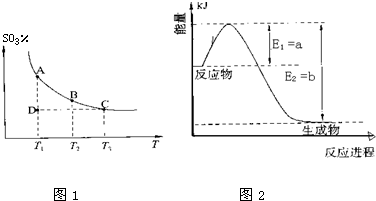
(3)对反应N2O4(g)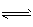 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示,下列说法正确的是______________ 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示,下列说法正确的是______________ 。
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
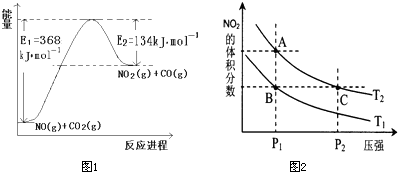
| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 298 | 398 | 498 |
| 平衡常数K | 2.44ⅹ10-6 | K1 | K2 |
| 9 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
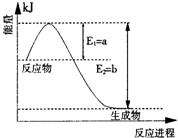
| 催化剂 |
| 高温高压 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com