
 常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | HX的酸性强于HY的酸性 | |
| B. | a点的c(Y-)与b点的c(X-)相等 | |
| C. | 水的电离程度:a点小于c点 | |
| D. | 若两溶液同时升高温度,则c(Y-)和c(X-)均增大 |
分析 A.相同浓度时,AG的值越大,溶液中氢离子浓度越大;
B.a、b两点的AG值相同,即氢离子浓度相同;
C.AG的值越大,溶液中氢离子浓度越大,对水的电离的抑制程度越大;
D.AG=12,说明c(H+)=0.1mol/L.
解答 解:A.相同浓度时,AG的值越大,溶液中氢离子浓度越大,稀释前HX的溶液中AG的值大,即HX溶液中氢离子浓度大,所以HX的酸性比HY强,故A正确;
B.a、b两点的AG值相同,即氢离子浓度相同,则两个溶液中氢氧根离子的浓度也相同,所以c(Y-)的c(X-)相同,即a点的c(Y-)与b点的c(X-)相等,故B正确;
C.AG的值越大,溶液中氢离子浓度越大,对水的电离的抑制程度越大,a点的AG值大,a点溶液中氢离子浓度大,水的电离程度小,所以水的电离程度:a点小于c点,故C正确;
D.稀释前,HX的溶液中AG=12,说明c(H+)=0.1mol/L,而酸的浓度为0.1mol/L,所以HX为强酸,在溶液中完全电离,升高温度,溶液中c(X-)不变,故D错误.
故选D.
点评 本题考查弱电解质的电离平衡,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,注意把握题干中的信息,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 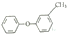 的同分异构体中,有醇、酚、酯类物质 的同分异构体中,有醇、酚、酯类物质 | |
| B. | 1mol 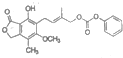 最多能与含5.0molNaOH的水溶液完全反应 最多能与含5.0molNaOH的水溶液完全反应 | |
| C. | 纯净物C4H8的氢种类最多为3种 | |
| D. | 化学式为C8H8的有机物,一定能和溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当X是活泼的金属时,它一定是强碱 | |
| B. | X是得电子能力很强的非金属元素,X-0-H一定为酸 | |
| C. | X-0-H的水溶液不能导电 | |
| D. | X-0-H不可能是直线形的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电时,正极的质量会变小 | |
| B. | 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气 | |
| C. | 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑ | |
| D. | 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
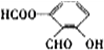 、
、 、
、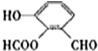 ..
..查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5KMnO4=K2MnO4+K3MnO4+K3MnO2+3O2↑ | |
| B. | 2KMnO4=K2MnO4+MnO2+O2↑ | |
| C. | 4KMnO4=2K2MnO4+2MnO2+3O2↑ | |
| D. | 3KMnO4=K3MnO4+2MnO2+2O2↑ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是( )
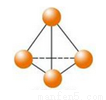
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882 kJ热量
C.N4(g)═ 2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com