
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| D | D元素的单质在C元素的单质燃烧,发出黄色火焰 |
| E | E与C形成的化合物H在大气中形成硫酸型酸雨 |
| F | 与E同周期,原子半径在该周期最小 |
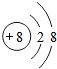 ;F为Cl元素,氯原子结构示意图为:
;F为Cl元素,氯原子结构示意图为: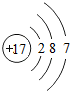 ,
,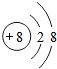 ;
; ;
;

 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、钠的还原性很强,在空气中易变质,久置后变为过氧化钠 |
| B、氢氧化钠溶液可长时间保存在带磨口玻璃塞的试剂瓶中 |
| C、新制的氯水通常保存在棕色玻璃试剂瓶中,并现用现配 |
| D、漂粉精的有效成分为氯化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,当出现大量晶体是,才能停止加热,用余热加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,萃取剂的密度应比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 浓H2SO4 |
| △ |
| CH3OH |
| 浓H2SO4 |

 和
和 也可以发生类似反应①的反应,反应后有机产物的结构简式为
也可以发生类似反应①的反应,反应后有机产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:11 | B、11:3 |
| C、1:4 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A、反应开始20s内二氧化氮的平均反应速率是0.001mol?L-1 |
| B、80s时混合气体的颜色与60s时颜色相同,比40s时的颜色深 |
| C、80s时向容器内加0.32molHe,同时将容器扩大为4L,则平衡不移动 |
| D、若起始投料为0.20molN2O4相同条件下达到平衡,则各组分的含量与原平衡相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
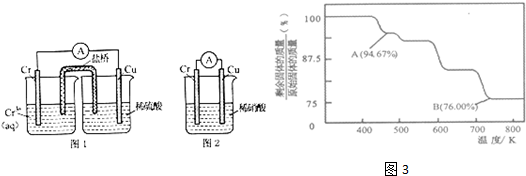
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①t1时改变的条件可能是升高了温度或增大了压强 |
| B、图②该微粒仅为18O2-不能为16O2- |
| C、图③若A为CaO,则B可能为MgO |
| D、图④中的△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Ag2O为负极 |
| B、Ag2O发生还原反应 |
| C、原电池工作时,正极区溶液pH值减小 |
| D、原电池工作时,负极区溶液pH值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com