
| A、Fe3+、NO3-、Cl-、Na+ |
| B、Ca2+、HCO3-、Cl-、K+ |
| C、NH4+、Fe2+、SO42-、NO3- |
| D、Cl-、SO42-、K+、Na+ |


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| A、二氧化硫与水反应生成硫酸 |
| B、二氧化硫是酸性氧化物,能被氨水吸收 |
| C、二氧化硫是有毒气体,不能用于杀菌消毒 |
| D、正常雨水的pH为5.6,因为其中溶解了二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+ |
| B、Fe2+ |
| C、Fe3+ |
| D、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Mg2+、H+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、Na2CO3溶液的水解:CO32-+2H2O?H2CO3+2OH- |
| D、碳酸镁跟硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、HS-的水解方程式:HS-+H2O?S2-+H3O+ |
| C、CO32-的水解方程式:CO32-+H2O?HCO3-+OH- |
| D、AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32-═Al2(CO3)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、能发生氧化还原反应的只有①、②、④、⑥ |
| B、将反应①和反应③产生的气体混合,气体颜色发生变化 |
| C、反应⑤生成的固体在空气中高温灼烧只发生分解反应 |
| D、将气体1和气体3冷凝再混合,能计算出所得溶液的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
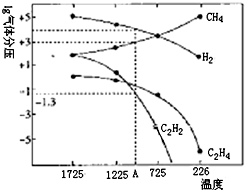 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com