
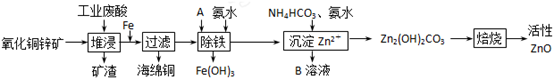
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
分析 氧化铜锌矿先用稀硫酸溶解,然后向所得溶液中加入铁粉将铜置换出来,加氧化剂A将Fe2+氧化成Fe3+,加氨水调节溶液的PH,将其除去,再用碳酸氢铵洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到氧化锌,
(1)相同条件下,溶解度大的物质先溶解;
(2)考虑除杂过程不引入新的杂质;
(3)PH的范围应是使铁沉淀完全而锌不沉淀;
(4)结合题给信息利用工业废酸和氮肥考虑;
(5)从题给信息写出反应物和生成物,配平即可.
解答 解:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,故答案为:BC;
(3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2,则除铁PH范围为:3.2~6.2,故答案为:3.2~6.2;
(4)因所用废酸为硫酸,B又可作氮肥,所以B为NH4)2SO4,故答案为:(NH4)2SO4;
(5)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl-,根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
点评 本题属于工艺流程图方面题目,要搞清实验目的和题给信息,结合流程和题目设问正确解题,本题难度中等.


科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
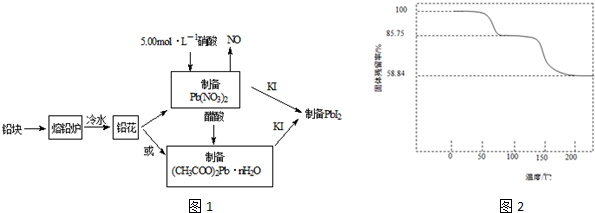
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
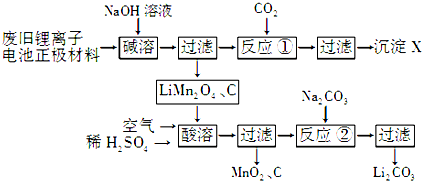
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
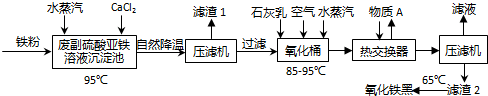
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com