
| A.逸出气体若用碱石灰吸收,增重b克。则测定混合物中Na2CO3的质量分数偏小 |
| B.把所得溶液加热蒸干,并灼烧至恒重,得b克固体。蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C.某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D.产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
 Na2CO3+CO2↑+H2O。蒸干过程中即使未搅拌,在灼烧时也会把结晶水及溶剂水蒸发掉,所以对所测Na2CO3的质量分数无影响。错误。C.某NaOH标准溶液露置于空气,会有一部分发生反应:CO2+2NaOH=Na2CO3+H2O。若以甲基橙为指示剂,由于它的变色点为4.4,此时Na2CO3、NaOH都会与HCl发生反应,所以对所测Na2CO3的质量分数无影响。错误。D. 若测定其体积时忘记调平量气管和水准管内液面,则V(CO2)偏小,NaHCO3含量就偏少,故导致Na2CO3的质量分数偏大。错误。2CO3和NaHCO3的性质及各种实验方法测定含量的误差分析的知识。
Na2CO3+CO2↑+H2O。蒸干过程中即使未搅拌,在灼烧时也会把结晶水及溶剂水蒸发掉,所以对所测Na2CO3的质量分数无影响。错误。C.某NaOH标准溶液露置于空气,会有一部分发生反应:CO2+2NaOH=Na2CO3+H2O。若以甲基橙为指示剂,由于它的变色点为4.4,此时Na2CO3、NaOH都会与HCl发生反应,所以对所测Na2CO3的质量分数无影响。错误。D. 若测定其体积时忘记调平量气管和水准管内液面,则V(CO2)偏小,NaHCO3含量就偏少,故导致Na2CO3的质量分数偏大。错误。2CO3和NaHCO3的性质及各种实验方法测定含量的误差分析的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
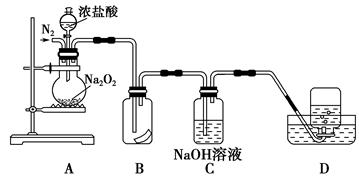
 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①中反应,过氧化钠作氧化剂,水作还原剂 |
| B.②中反应既是化合反应又是放热反应 |
| C.③中的实验现象证明溶液中不含有Fe2+ |
| D.将①中所得溶液加入到③的溶液中,静置,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 g ` | B.15.5 g |
| C.11.7 g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
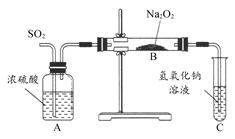
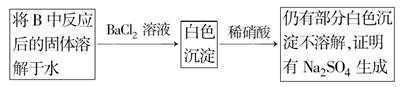
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
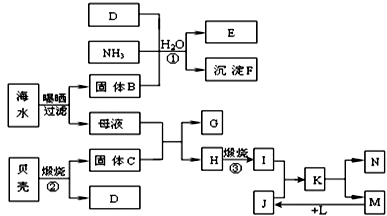
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 g | B.15.5 g | C.11.7 g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com