
|
�������� (��缫)����ʽ��д��ȷ���� | |
A�� |
��������Һ�м��������ˮ�� Ag+��NH3��H2O��AgOH����NH4+ |
B�� |
��������������ʴ��������Ӧ�� 4OH����4e����2H2O��O2�� |
C�� |
20 mL��0.1 mol/L��AlCl3��Һ�м���70 mL��0.1 mol��L��1��NaOH��Һ��2Al3+��7OH����Al(OH)3����AlO2����2H2O |
D�� |
�� Ba(OH)2ϡ��Һ����μ���NH4HSO4��Һ���պó�����ȫ��Ba2+��2OH����H+��SO42����NH4+��BaSO4����NH3��H2O��H2O |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�鲽�� | ʵ������ | ʵ����ۣ�����2�����ӷ���ʽ��ʾ�� |
| 1��ȡʳ��������һ֧�Թ��У���������������ˮ���� | ������ȫ�ܽ� | ʳ�μ�����ض�������ˮ |
| 2����������Һ�еμ�������������������Һ���� | ��Һ�����ػ�ɫ | 2IO3-+5HSO3-�TI2+5SO42-+3H++H2O 2IO3-+5HSO3-�TI2+5SO42-+3H++H2O |
| 3�� ����������Һ�еμӵ�����Һ���� ����������Һ�еμӵ�����Һ���� |
��Һ�����ɫ | ����������� ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������һ�������Դ������ͨ�����ַ����Ƶã�
������һ�������Դ������ͨ�����ַ����Ƶã�| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ�鲽�� | ʵ������ | ʵ����ۣ�����2�����ӷ���ʽ��ʾ�� |
| 1��ȡʳ��������һ֧�Թ��У���������������ˮ���� | ������ȫ�ܽ� | ʳ�μ�����ض�������ˮ |
| 2����������Һ�еμ�������������������Һ���� | ��Һ�����ػ�ɫ | 2IO3-+5HSO3-�TI2+5SO42-+3H++H2O 2IO3-+5HSO3-�TI2+5SO42-+3H++H2O |
| 3������������Һ�еμӵ�����Һ���� | ��Һ�����ɫ | ����������� ����������� |
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 Ni��CO��4��g�� �÷�Ӧ�ġ�H
Ni��CO��4��g�� �÷�Ӧ�ġ�H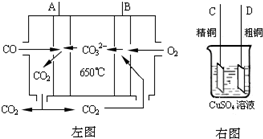
| 10 |
| 11 |
| ||
| ������ |
| ʯ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�챱���г�����������ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��13�֣�������һ�������Դ������ͨ�����ַ����Ƶá�
(1) ��ҵ����ˮú�������������йػ�ѧ����ʽ�ǣ�
��Ӧһ��C( s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) ��H�� 0
CO(g) + H2(g) ��H�� 0
��Ӧ����CO(g) + H2O(g)  CO2(g) + H2��g�� ��H �� 0
CO2(g) + H2��g�� ��H �� 0
������Ӧһ��t��ʱ�ﵽ��ѧƽ��״̬������¶��¸÷�Ӧ�ĵ�ƽ�ⳣ������ʽ
K = ��
����427��ʱ��CO ��H2O(g)��0.01molͨ�����Ϊ2�����ܱ������з�Ӧ��5����ʱ�ﵽƽ��״̬���÷�Ӧ��ƽ�ⳣ����9����CO��ת������ ����CO��Ũ�ȱ仯��ʾ�ķ�Ӧ����v(CO)�� mol /��L��min����
��2�����õ�ⱥ��ʳ��ˮҲ���Ƶ���������ͼΪ���ʳ��ˮ��ʾ��ͼ��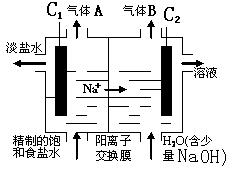
��ش�
�� C1�缫�� ��(�����������)��C2�缫�ĵ缫��Ӧʽ�� ��
�ڸõ�ⷴӦ�����ӷ���ʽ�� ��
��3��ͨ�����з���Ҳ���Եõ�������
��֪�� CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2kJ��mol��1
CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��-247.4 kJ��mol��1
1molCH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)�ķ�Ӧ���� kJ��mol��1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com