
【题目】实验室用NaOH溶液捕获CO2。向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.
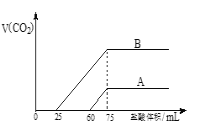
(1)曲线B表明原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_____________,其物质的量之比为__________________。当耗盐酸0<v(HCl)<25 mL时发生的离子反应为:____________。
(2)曲线A表明,最初通入的CO2在标准状况下的体积为_________mL。
(3)通过计算求出原NaOH溶液的物质的量浓度______________。
【答案】Na2CO3 和NaHCO3 1:1 CO32-+H+= HCO3- 33.6 0.15mol/L(不写单位扣1分)
【解析】
(1)溶质成分的确定以及量的关系、离子方程式书写等;
(2)根据气体摩尔体积的公式计算;根据物质的量浓度的公式计算。
(1)根据B曲线分析可知不产生气体消耗的盐酸小于产生气体消耗的盐酸,所以对应的溶质为Na2CO3 和NaHCO3;根据图像可知第一阶段发生的反应的离子方程式为:CO32-+H+=HCO3-;第二阶段对应的反应为HCO3-+H+=H2O+CO2↑,根据第一阶段和第二阶段消耗的盐酸的体积可知碳酸钠和碳酸氢钠的物质的量之比为1:1;
(2)根据图像分析可知曲线A中盐酸的体积从60mL到75mL时产生二氧化碳,所以根据HCO3-+H+=H2O+CO2↑可知产生的二氧化碳在标准状况下的体积为0.1mol/L×(75mL-60mL)×10-3L/mL×22.4L/mol×103mL/L=33.6mL,所以开始通入的二氧化碳的体积为33.6mL;
(3)根据曲线A或曲线B产生气体体积达到最大值时,溶液中的溶质只有氯化钠,因此50mL原氢氧化钠溶液中氢氧化钠的物质的量为0.1mol/L×75mL×10-3L/mL=7.5×10-3mol,所以原氢氧化钠的物质的量浓度为(7.5×10-3mol)÷(50mL×10-3L/mL)=0.15mol/L。


科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
(5)下列图像符合反应①的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL浓度均为0.1 mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb =1.8×10-5。下列说法正确的是
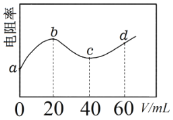
A.b→c过程发生的反应:MOH+CH3COOH=CH3COOM+H2O
B.c点溶液中:c(CH3COOH)+c(CH3COO–)=2c(NH4+)
C.d 点溶液中:c(CH3COO–)c(CH3COOH)>c(M+)>c(H+)>c(OH–)
D.a→c过程中水的电离程度一直在增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得。下列叙述正确的是( )
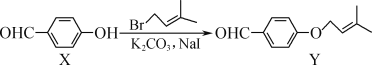
A.Y的分子式为C12H14O2
B.可用FeCl3溶液鉴别X和Y
C.Y能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
D.1molX与4molH2完全加成所得产物分子中含2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
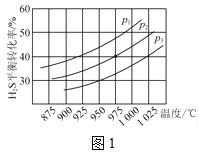
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
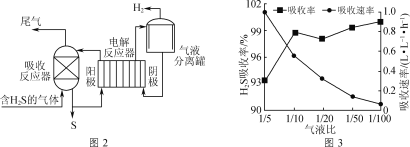
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
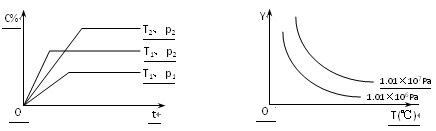
A.反应物A的物质的量 B.平衡混合气中物质B的质量分数
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com