
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
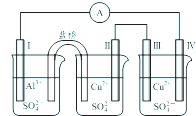 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
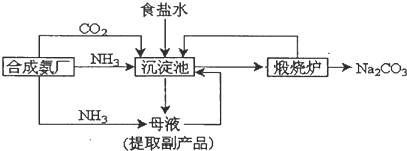
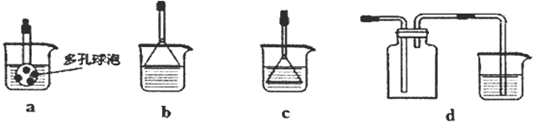
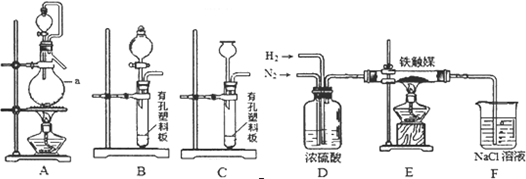
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、VA=0.5mol/(L.min) |
| B、VB=0.3mol/(L.min) |
| C、Vc=2.4mol/(L.min) |
| D、VD=1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、碳酸镁和盐酸混合:CO32-+2H+=CO2↑+H2O |
| C、NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO |
| D、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应:2Na+2H2O═2 Na++2OH-+H2↑ | ||||
| C、稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
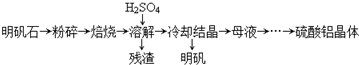
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目:高中化学 来源: 题型:
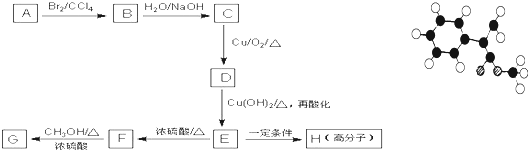
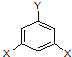 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com