
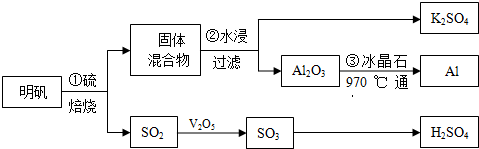
分析 从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al,
(1)依据化学方程式中元素化合价变化分析判断,元素化合价降低的做氧化剂,元素化合价升高的做还原剂;
(2)矿石的颗粒大小、温度及是否搅拌等会影响浸取率;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到;
(4)步骤③电解Al2O3,制得Al,阳极材料需要定期地进行更换,原因是该极材料不断被消耗;
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应;
(6)依据硫元素守恒计算得到.
解答 解:从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al,
(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应中,硫单质硫元素化合价0价,升高到SO2中为+4价,硫酸根离子中硫元素化合价从+6价变化为SO2中+4价,则S为还原剂,被氧化成二氧化硫,KAl(SO4)2•12H2O为氧化剂,被还原成二氧化硫,根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:AC;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发结晶的方法得到,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发结晶;
(4)电解熔融氧化铝,阳极氯离子放电生成氯气,阴极是铝离子放电生成铝,反应的化学方程式为2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑,在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2$\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO,所以需定期地进行更换,
故答案为:2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑;阳极中碳被氧化成CO2(CO);
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;
(6)焙烧a吨明矾(摩尔质量为b g/mol),4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,生成SO2物质的量为$\frac{a×10{\;}^{6}g}{bg/mol}$×$\frac{9mol}{4mol}$,SO2 的转化率为96%,物质的量为$\frac{a×10{\;}^{6}g}{bg/mol}$×$\frac{9mol}{4mol}$×96%,可生产质量分数为98%的H2SO4质量为$\frac{9mol×98g/mol×96%×a}{4mol×bg/mol×98%}$=$\frac{216a}{b}$,
故答案为:$\frac{a×10{\;}^{6}g/t}{bg/mol}$=$\frac{9mol×98g/mol×96%×a}{4mol×bg/mol×98%}$=$\frac{216a}{b}$.
点评 本题以铝的化合物为载体考查了物质间的反应、物质的分离和提纯等知识点,明确物质之间的反应是解本题关键,再结合原子守恒来分析解答,这种综合性较强的题型是高考热点,需利用基础知识细心分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
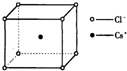 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )| A. | 2Ma3d | B. | M/(a3d) | C. | M/(2a3d) | D. | 2M/(a3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个N2和O2的混合气体中质子数不可能是15NA | |
| B. | 1 L 1 mol•L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA | |
| C. | 58g 分子式为C4H10的有机物中,所含有的甲基数一定为2NA | |
| D. | NA个CH4和NA个Cl2光照下充分反应,被取代的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2是氧化产物,又是还原产物 | |
| B. | ZnI2是氧化产物,又是还原产物 | |
| C. | ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂 | |
| D. | ICl跟H2O的反应,是自身氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com