
【题目】请用下图所示仪器装罝设计一个电解饱和食盐水,并测定电解产生氢气的 体积和检验氯气氧化性的实验装置。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母);a接 , 接 ,b接 , 接 。______________
(2)证明有Cl2生成的实验现象是____________。
(3)实验时,装置中的铁电极接电源的____________极,石墨电极的反应式为____________。
(4)装置E读取气体体积时,应进行的实验操作是____________,若实验结束后装置E的读数(已折算成标准状况)为5.60mL,电解后溶液的体积恰好为50.0mL,则溶液中OH-的浓度为________mol·L-1。
【答案】gfh,dec 装置C中的溶液颜色变蓝 负 2Cl--2e-==Cl2↑ 上下移动装置E,使装置E与D中的液面相平 0.01 mol·L-1
【解析】
用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,即a电极为铁,应为电解池的阴极,则生成氢气,可知b端为氯气,A接储气瓶的g→f,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,用淀粉KI溶液检验氯气,用NaOH溶液吸收氯气,防止污染环境,以此解答该题。
(1)由以上分析可知A接储气瓶的g→f,,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,B接洗气瓶的d→e,生成的Cl2在洗气瓶中使淀粉碘化钾溶液变蓝,多余的Cl2用NaOH溶液吸收,
故答案为:g;f;h;d;e;c;
(2)氯气可氧化KI,使其变为碘单质,遇淀粉变蓝,则证明有Cl2生成的实验现象为:装置C中的溶液颜色变蓝,
故答案为:装置C中的溶液颜色变蓝;
(3)装置中的铁电极连接电源的负极,所发生的反应为2H++2e═H2↑,石墨电极接电源的正极,所发生的反应为2Cl--2e-==Cl2↑,
故答案为:负;2Cl--2e-==Cl2↑;
(4)为使量气管和水平管内的液面位置保持同一水平,在读取气体体积时,需上下移动装置E,使装置E与D中的液面相平;氢气物质的量为![]() = 0.00025 mol,由2NaCl+2H2O
= 0.00025 mol,由2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑可知,n(NaOH) = 2 n(H2) = 0.0005 mol,则c(OH) =
2NaOH+Cl2↑+H2↑可知,n(NaOH) = 2 n(H2) = 0.0005 mol,则c(OH) = ![]() = 0.01 molL1,
= 0.01 molL1,
故答案为:上下移动装置E,使装置E与D中的液面相平;0.01 mol·L-1。


科目:高中化学 来源: 题型:
【题目】在2A(g)+B(s)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5 mol·L-1·s-1 B. v(B)=0.5 mol·L-1·s-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是

A. 元索Ⅹ和元Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(X)
C. 气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D. 元素Z的氧化物对应水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用如图装置制备氨气并探究相关性质。

(1)装置A 中,盛有浓氨水的仪器名称为_____。装置B 的作用是_____。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填 I 或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C 中 CuO 粉末变红,D 中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为_____,该反应证明氨气具有还原性;氨与氧气的在催化剂作用下的反应也体现了这一性质,该反应化学方程式为_____。
(4)该实验缺少尾气吸收装置,如图中能用来吸收尾气的装置是_____(填装置序号)。

(5)实验室还可用如图所示装置制备氨气,化学反应方程式为_____。

(6)现将 1.92gCu 投入到一定量的浓HNO3 中,Cu 完全溶解,生成气体颜色越来越浅,共收集到标准状况下 672mL 的NOX 混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的 O2 的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
请回答下列问题:
(1)请列举海水淡化的一种方法__________________________。
(2)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是______(填字母)。
A.①②③④ B.②③④① C.②④③① D.③④②①
(3)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(4)步骤I已经获得Br2,步骤II又将Br2还原为Br—,其目的是_____________________
(5)写出步骤III反应的离子方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成甜味剂阿斯巴甜 :
:

已知:①芳香化合物A能发生银镜反应,核磁共振氢谱显示有5种不同化学环境的氢原子;
②
③RCN![]() RCOOH
RCOOH
④
回答下列问题:
(1)F的结构简式是_________________________________________。
(2)下列说法正确的是________。
A.化合物A的官能团是羟基
B.化合物B可发生消去反应
C.化合物C能发生加成反应
D.化合物D可发生加聚反应
(3)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式:_________。
(4)写出同时符合下列条件的 D的同分异构体的结构简式:_________。
①有三种化学环境不同的氢原子;②含苯环的中性物质。
(5)参照上述合成路线,设计一条由甲醛为起始原料制备氨基乙酸的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列实验装置图探究铜与稀硝酸反应的还原产物并进行喷泉实验(假设药品足量),请回答下列问题:

(1)实验室用金属铜和稀硝酸制取NO气体的离子方程式为_______________________。
(2)实验开始时,该同学进行了如下的操作步骤,正确的顺序是__________(填选项序号)
①打开活塞与止水夹
②U形管右侧酸液与铜丝分离后,打开活塞
③检查气密性,组装好其它部分仪器
④从长颈漏斗往U形管中注入稀硝酸至与橡皮塞下端齐平
⑤关闭活塞与止水夹
(3)第(2)题中操作④的目的是________________________________________。
(4)上述实验过程中长颈漏斗所起的作用是______________________________。
(5)能证明稀硝酸与铜反应还原产物是NO气体的实验现象是_____________(填选项字母)。原因是____________________________(用化学方程式表示)。
A.U形管右侧中收集到无色气体
B.U形管右侧产生的无色气体进入圆底烧瓶后接触空气变为红棕色
C.U形管中溶液颜色变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。如图是合成具有特殊功能高分子材料W( )的流程:
)的流程:

已知:
I. ![]() R-CH2OH
R-CH2OH
II. ![]() =R2-OH
=R2-OH![]() ,R、R2、R3代表烃基
,R、R2、R3代表烃基
(1)①的反应类型是___________。
(2)②是取代反应,其化学方程式是____________________。
(3)D的核磁共振氢谱中有两组峰且面积之比是1∶3,不存在顺反异构。D的结构简式是_______。
(4)⑤的化学方程式是_________________。
(5)F的官能团名称____________________;G的结构简式是____________________。
(6)⑥的化学方程式是_________________________。
(7)符合下列条件的E的同分异构体有__________种(考虑立体异构)。
①能发生水解且能发生银镜反应 ②能与Br2的CCl4溶液发生加成反应
其中核磁共振氢谱有三个峰的结构简式是__________________。
(8)工业上也可用 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,![]() 不易发生取代反应)
不易发生取代反应)
![]() _______________。
_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
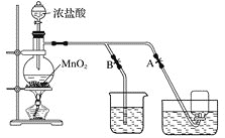
(1)烧杯中盛放的液体是__________,其作用是_________,水槽中盛放的液体是_________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应__________________________;当氯气纯度合乎要求时,应__________________________________,当氯气收集完毕时,应______。
(3)将8.7 g二氧化锰与含氯化氢14.6 g的浓盐酸共热制氯气,甲同学认为可制得氯气 7.1 g,乙同学认为制得氯气的质量小于7.1 g,你认为________(填“甲”或“乙”)同学正确,原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com