
| A. | 简单离子的半径:Z>R>W>Y | |
| B. | Y、Z、W 三种元素组成的化合物的水溶液可能显碱性 | |
| C. | Z 与 Y、Z 与 W 形成的化合物的化学键完全相同 | |
| D. | WY2、Y3 等可作为新的自来水消毒剂替代 W2,主要原因是 WY2、Y3 的氧化性比 W2 更强 |
分析 X、Y、Z、R、W是原子序数依次增大的五种短周期元素,Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为O元素,R为S元素,RY2为SO2;W的原子序数大于S元素,则W为Cl元素;Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数=7-6=1,处于第ⅠA族,原子序数大于O元素,则Z为Na元素;25℃时0.1mol•L-1X和W形成化合物的水溶液pH为1,属于强酸,则X为H元素,据此进行解答.
解答 解:X、Y、Z、R、W是原子序数依次增大的五种短周期元素,Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为O元素,R为S元素,RY2为SO2;W的原子序数大于S元素,则W为Cl元素;Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数=7-6=1,处于第ⅠA族,原子序数大于O元素,则Z为Na元素;25℃时0.1mol•L-1X和W形成化合物的水溶液pH为1,属于强酸,则X为H元素,
A.Y、Z、R、W的简单离子分别为O2-、Na+、S2-、Cl-、电子层结构相同核电荷数越大离子半径越小、电子层越多离子半径越大,故离子半径:S2->Cl->O2->Na+,故A错误;
B.Y、Z、W三种元素组成的化合物有NaClO、氯酸钠等,NaClO溶液中次氯酸根离子水解,溶液显碱性,故B正确;
C.Z与Y可以形成Na2O、Na2O2,前者含有离子键、后者含有离子键、共价键,而Z与W形成的化合物为NaCl,只含有离子键,故C错误;
D.WY2、Y3、W2分别为ClO2、O3、Cl2,ClO2、O3具有强氧化性,能够杀菌消毒,可作为新的自来水消毒剂替代Cl2,但不是ClO2、O3的氧化性比Cl2更强,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素是解题的关键,“Y、R元素的位置及二者形成的共价化合物RY2”是推断的突破口,注意掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | Br- | B. | OH- | C. | K+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
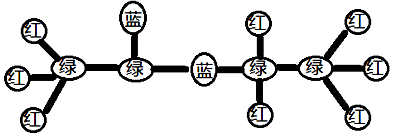
| A. | 该有机物的同分异构体中能够与碳酸氢钠溶液反应产生气体的不同结构有两种 | |
| B. | 实验室制备该有机物的反应类型与乙烯和溴的四氯化碳溶液反应的反应类型相同 | |
| C. | 1mol该有机物与足量的NaOH溶液反应,消耗的氢氧化钠的物质的量为1mol | |
| D. | 当该有机物与丙烷的总物质的量不变时,无论二者以何种比例混合,完全燃烧的耗氧量为定值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:b>c | B. | 化合物ac是弱电解质 | ||
| C. | 化合物db2可作漂白剂 | D. | 化合物ad的水溶液能蚀刻玻璃. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为:Li-e-=Li+ | |
| B. | 正极反应式为:FeS2+4e-=Fe+2S2- | |
| C. | 电池放电时K+向正极移动 | |
| D. | 可用KCl、LiCl的水溶液做电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
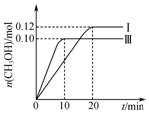 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:推断题
(1)石油裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产化工产品的转化关系图。
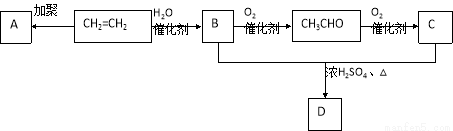
填写下列各空:
CH2=CH2  B的反应类型: ,
B的反应类型: ,
②A的结构简式: ,
③B+C D反应的化学方程式: ,
D反应的化学方程式: ,
④区别乙烯和乙烷时,可将两种气体分别通入 中,观察溶液变化。
(2)(某研小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
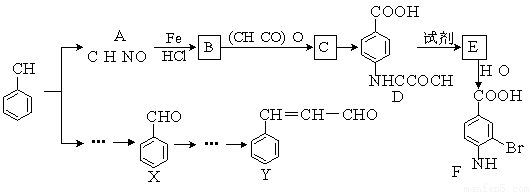
已知:①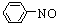
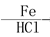
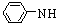
2CH3CHO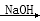 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO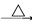 CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
①下列有关F的说法正确的是 ;
A.分子式是C7H7NO2Br B.能形成内盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
②C→ D的反应类型是 ;
③在合成F的过程中,B→C步骤不能省略,理由是 ;
④写出同时符合下列条件的A的一种同分异构体的结构式 ;
Ⅰ苯环上只有两种不同化学环境的氢原子 Ⅱ分子中含有 -CHO
⑤以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO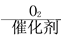 CH3COOH
CH3COOH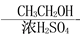 CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com