


科目:高中化学 来源: 题型:
 在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.
在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.查看答案和解析>>
科目:高中化学 来源: 题型:
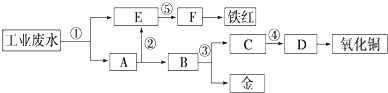
查看答案和解析>>
科目:高中化学 来源: 题型:
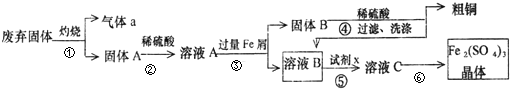
查看答案和解析>>
科目:高中化学 来源: 题型:
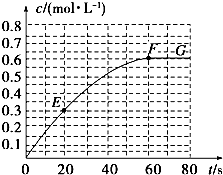 298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.
298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 原因解释 |
| A | 将一片较簿的铝片放在酒精灯火焰上灼烧 | 铝片慢慢熔化呈液滴状 | 铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了 |
| B | 将等表面积的镁条、铝 片(均除去氧化膜)分 别放入装有等浓度、等 体积盐酸的两支试管中 | 都产生气泡,镁条表面产生气泡更快 | 镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
| C | 在打磨过的铁片上先滴 一滴饱和食盐水,再滴 一滴酚酞 | 液滴的外圈先出现红色 | 铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性 |
| D | 取少量淀粉加稀硫酸, 加热几分钟,冷却后加 入新制氢氧化铜悬浊 液,加热至沸腾 | 未见砖红色沉淀生成 | 淀粉水解后没有葡萄糖生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的硝酸是0.4mol |
| B、消耗氧气的体积为1.68 L |
| C、此反应过程中转移的电子为0.3 mol |
| D、混合气体中含NO21.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
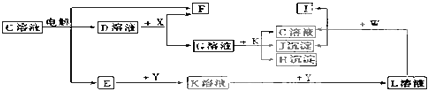
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降温 |
| B、加入CaSO4 |
| C、加入BaCl2 |
| D、加水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com